题目内容
设为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,15g甲基(-CH3)所含的中子数为6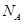 |
B.一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3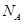 |
C.在1L的碳酸钠溶液中,若c(CO32-)=1mol/L,则Na+个数为2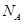 |
D.含4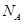 个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的浓度为1mol/L 个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的浓度为1mol/L |
A
试题分析:A、甲基(-CH3)的相对分子质量为15,故15g甲基的物质的量为
 =1mol,一个碳原子含6个中子,氢原子不含中子,故1mol甲基含6NA个中子,A正确;B、铁与浓硫酸在加热条件下发生反应,当铁过量时生成二价铁,当铁少量时生成三价铁,故转移电子数不一定为3NA,B错误;C、在1L的碳酸钠溶液中,碳酸根离子发生水解,离子浓度减小,故若c(CO32-)=1mol/L,则c(Na+)>2mol/L,个数大于2NA,C错误;D、固体Na2O2中含Na+和O2-,个数比为2:1,当含4NA个离子时,固体过氧化钠的物质的量为
=1mol,一个碳原子含6个中子,氢原子不含中子,故1mol甲基含6NA个中子,A正确;B、铁与浓硫酸在加热条件下发生反应,当铁过量时生成二价铁,当铁少量时生成三价铁,故转移电子数不一定为3NA,B错误;C、在1L的碳酸钠溶液中,碳酸根离子发生水解,离子浓度减小,故若c(CO32-)=1mol/L,则c(Na+)>2mol/L,个数大于2NA,C错误;D、固体Na2O2中含Na+和O2-,个数比为2:1,当含4NA个离子时,固体过氧化钠的物质的量为 mol,溶于水配成1L溶液时,所得溶液中Na+的浓度为
mol,溶于水配成1L溶液时,所得溶液中Na+的浓度为 mol/L,故D错误;故选A。
mol/L,故D错误;故选A。
练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
 Si3N4+6CO,生成1 mol Si3N4时共转移12 NA电子
Si3N4+6CO,生成1 mol Si3N4时共转移12 NA电子 Ca2++2OH-,饱和石灰水的密度为d g/cm3,溶液pH=12。下列有关叙述中,不正确的是
Ca2++2OH-,饱和石灰水的密度为d g/cm3,溶液pH=12。下列有关叙述中,不正确的是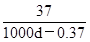 (g/100gH2O)
(g/100gH2O) 值不变
值不变