题目内容
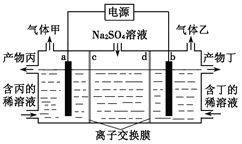
如图所示表示的是电解饱和食盐水的装置,阴极材料、阳极材料都是碳棒,饱和食盐水中含有少量酚酞。
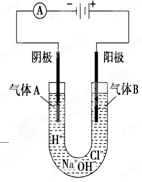
(1)接通电源后,饱和食盐水中的阳离子的移动方向是:向 极移动。
(2)电极上生成了气体A和B,生成气体A的电极反应式是 。
(3)随着气体的生成,饱和食盐水中产生了两种不同的颜色:一种是 色,其产生的位置是 (填“阴极区”或“阳极区”);另一种是 色,其产生的位置是 (填“阴极区”或“阳极区”)。

(1)接通电源后,饱和食盐水中的阳离子的移动方向是:向 极移动。
(2)电极上生成了气体A和B,生成气体A的电极反应式是 。
(3)随着气体的生成,饱和食盐水中产生了两种不同的颜色:一种是 色,其产生的位置是 (填“阴极区”或“阳极区”);另一种是 色,其产生的位置是 (填“阴极区”或“阳极区”)。
(1)阴极 (2)2H++2e-=H2↑ (3)浅黄绿 阳极区 红 阴极区
试题分析:(1)电解池中阳极失去电子发生氧化反应,阴极得到电子,发生还原反应,所以电解池中阳离子向阴极移动。根据装置图可知,接通电源后,饱和食盐水中的阳离子向阴极移动。
(2)A在阴极生成,所以是溶液中的氢离子在阴极放电生成氢气,电极反应式是2H++2e-=H2↑。
(3)阳极是氯离子放电,生成氯气。氯气溶于水得到氯水,氯水是浅黄绿色的。阴极氢离子放电,破坏阴极周围水的电离平衡,使阴极周围溶液显碱性,溶液显红色。
点评:该题基础性强,试题紧扣教材,侧重对学生基础知识的巩固和训练,难度不大。明确电解池的工作原理是答题的关键,注意水的电离平衡的特点和影响因素。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目