题目内容
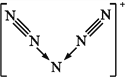
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N![]() N放出942 kJ热量。根据以上信息和数据,判断下列说法正确的是( )
N放出942 kJ热量。根据以上信息和数据,判断下列说法正确的是( )

A. N4属于一种新型的化合物 B. N4分子中存在非极性键
C. N4和N2是同分异构体 D. 1 mol N4转变成N2将吸收882 kJ热量
【答案】B
【解析】A.N4由N组成,是一种单质,而化合物是由不同元素组成的纯净物,选项A错误;B.N4分子中存在N-N非极性键,选项B正确;C.N4和N2互为同素异形体,不属于同分异构体,选项C错误;D.1molN4气体中含有0.6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167kJ=1002kJ,形成化学键放出的热量为2×942kJ=1884kJ,所以反应放热,放出的热量为1884kJ-1002kJ=882kJ,故应为放出882kJ热量,选项D错误;答案选B。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】(在Na+浓度为0.5 mol/L的某澄清溶液中,还可能含有下表中的若干种离子。(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为两种氧化物)
阳离子 | K+ | Ag+ | Ca2+ | Ba2+ |
阴离子 | NO3- | CO32- | SiO32- | SO42- |
现取该溶液100mL进行如下实验(气体体积在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 生成白色胶状沉淀并放出标准状况下0.56 L气体 |
Ⅱ | 将Ⅰ中产生的混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题:
(1)实验Ⅰ能确定一定不存在的离子是________;
(2)实验Ⅰ中生成气体的离子方程式为________;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)_____。
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c(mol/L) | 0.25mol/L |
(4)判断K+是否存在,若存在,其最小浓度为________,若不存在,请说明理由:________。