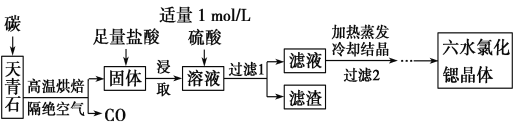
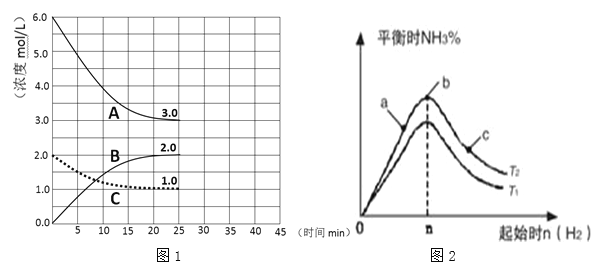
题目内容
【题目】下列实验操作完全正确的是
编号 | 实验 | 操作 |
A | 钠与水的反应 | 用镊子从煤油中取出金属钠,切下绿豆大小,放入装满水的烧杯中 |
B | 配制一定浓度的氯化钾溶液 | 准确称取氯化钾固体,放入到 |
C | 闻氯气的方法 | 用手轻轻地在瓶口扇动,使极少量氯气飘进鼻孔 |
D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个烧杯,上层液体继续从分液漏斗下端管口放出 |
A. A B. B C. C D. D
【答案】C
【解析】A.从煤油中取出金属钠,应用滤纸吸干表面的煤油,否则反应时可能发生爆炸,故A错误;B.不能在容量瓶中溶解,应在烧杯中溶解、冷却后转移到容量瓶中,故B错误;C.氯气有毒,则用手轻轻地在瓶口扇动,使极少量氯气飘进鼻孔,操作合理,故C正确;D.分液时,应避免上下层液体混合,则下层液体从分液漏斗下口放出,关闭活塞,换一个烧杯,上层液体继续从上口倒出,故D错误;故选C。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目