题目内容
【题目】A、B、C、D四种短周期元素,原子序数D>C>B>A,且B、C、D同周期,A、D同主族,B 原子的最外层只有一个电子,C的原子结构示意图如右图所示: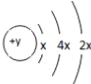 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空:
(1)C元素的名称为_______,其气态氢化物的化学式为________。
(2)D离子的离子结构示意图为__________________。
(3)A、B、C、D四种元素的原子半径由大到小的顺序为_______________________(用元素符号比较)
(4)B的最高价氧化物的水化物与A的氢化物的水溶液反应的离子方程式式为:_________________________________。
【答案】 硅 SiH4 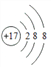 Na>Si>Cl>F OH-+HF= F-+H2O
Na>Si>Cl>F OH-+HF= F-+H2O
【解析】A、B、C、D四种短周期元素,原子序数D>C>B>A,C的原子结构示意图为 ,第一电子层只能容纳2个电子,故x=2,则C原子核外电子数为14,C为Si元素;D在同周期元素中原子半径最小,处于ⅦA族,原子序数大于Si,故D为Cl;A、D同主族,则A为F元素;B、C、D同周期,且B原子的最外层只有一个电子,故B为Na;
,第一电子层只能容纳2个电子,故x=2,则C原子核外电子数为14,C为Si元素;D在同周期元素中原子半径最小,处于ⅦA族,原子序数大于Si,故D为Cl;A、D同主族,则A为F元素;B、C、D同周期,且B原子的最外层只有一个电子,故B为Na;
(1)C元素的名称为硅,其气态氢化物的化学式为SiH4,正确答案:硅;SiH4。
(2)D为Cl元素,核电荷数为17,核外电子数为17,氯离子核外电子数为18,结构示意图: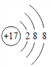 ;正确答案:
;正确答案: 。
。
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,A、B、C、D四种元素的原子半径由大到小的顺序为Na>Si>Cl>F,正确答案:Na>Si>Cl>F。
(4)B的最高价氧化物的水化物为氢氧化钠,A的氢化物的水溶液为氢氟酸,氢氧化钠与氢氟酸反应生成氟化钠和水,反应的离子方程式式为:OH-+HF= F-+H2O;正确答案:OH-+HF= F-+H2O。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案