题目内容
【题目】已知:
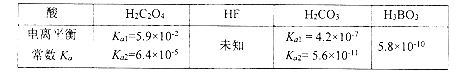
(1)为了证明HF是弱酸,甲、乙、丙三位同学分别设计以下实验进行探究。
① 甲同学取一定体积的HF溶液,滴入2 滴紫色石蕊试液,显红色,再加入NaF 固体观察到的现象是__________________,则证明HF 为弱酸.
② 乙同学取10ml未知浓度的HF 溶液,测其pH 为a ,然后用蒸馏水稀释至1000mL .再测其pH 为b ,若要认定HF 为弱酸,则a 、b 应满足的关系是b <_____________(用含a 的代数式表示)。
③ 丙同学用pH 试纸测得室温下0.10mol.L-1的HF 溶液的pH为2 ,则认定HF为弱酸,由丙同学的实验数据可得室温下HF 的电离平衡常数约为_______________.
(2)① 己知H3BO3 与NaOH 溶液反应的离子方程式为H3BO3 +OH-=B(OH)4- ,写出硼酸的电离方程式_____________________.
② 向等浓度的H2C2O4 与H3BO3混合溶液中逐滴加入NaOH 溶液,则与OH- 作用的粒子(包括分子和离子)依次为_____________,______________,_____________。
(3)向NaHC2O4 溶液中加入少量的Na2CO3 溶液,反应的离子方程式_______________.
【答案】
(1)①.红色变浅;②a+2;③1.0×10-3;
(2)①.H3BO3+H2O ![]() B(OH)4-+H+;②.H2C2O4、 HC2O4- 、H3BO3;
B(OH)4-+H+;②.H2C2O4、 HC2O4- 、H3BO3;
(3)2HC2O4- 十CO32- =2C2O42-+H2O +CO2↑;
【解析】
试题分析:根据几种酸的电离常数的大小可知,酸性H2C2O4>HC2O4->H2CO3>H3BO3>HCO3-。
(1)①加入NaF 固体,增大了F-浓度,若看到红色变浅,说明溶液中存在HF![]() H++ F-的平衡,说明HF 为弱酸,故答案为:红色变浅;
H++ F-的平衡,说明HF 为弱酸,故答案为:红色变浅;
②若HF 为弱酸,将10ml未知浓度的HF 溶液,用蒸馏水稀释至1000mL,溶液的pH变化将小于2,即b <a+2,故答案为:a+2;
③室温下0.10mol.L-1的HF 溶液的pH为2,则c(H+)=c(F-)=0.01mol/L,HF 的电离平衡常数=![]() ≈1.0×10-3,故答案为:1.0×10-3;
≈1.0×10-3,故答案为:1.0×10-3;
(2)① 根据H3BO3 与NaOH 溶液反应的离子方程式为H3BO3 +OH-=B(OH)4- ,说明H3BO3为一元酸,硼酸的电离方程式为H3BO3+H2O ![]() B(OH)4-+H+,故答案为:H3BO3+H2O
B(OH)4-+H+,故答案为:H3BO3+H2O ![]() B(OH)4-+H+;
B(OH)4-+H+;
②酸性H2C2O4>HC2O4->H2CO3>H3BO3>HCO3-。向等浓度的H2C2O4 与H3BO3混合溶液中逐滴加入NaOH 溶液,首先与酸性强的粒子反应,然后再与酸性弱的粒子反应,则与OH- 作用的粒子依次为H2C2O4、 HC2O4- 、H3BO3,故答案为:H2C2O4、 HC2O4- 、H3BO3;
(3)酸性H2C2O4>HC2O4->H2CO3>H3BO3>HCO3-。根据酸性强的可以反应生成酸性弱的粒子,向NaHC2O4 溶液中加入少量的Na2CO3 溶液,反应的离子方程式为2HC2O4- 十CO32- =2C2O42-+H2O +CO2↑,故答案为:2HC2O4- 十CO32- =2C2O42-+H2O +CO2↑。