��Ŀ����
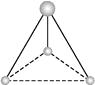
����Ŀ������ԭ������С��20��A��B��C��D��E��F6��Ԫ�أ����ǵ�ԭ����������������֪BԪ���ǵؿ��к�������Ԫ�أ�A��C�ļ۵�������ͬ��B��D�ļ۵�����Ҳ��ͬ����A��C��Ԫ��ԭ�Ӻ��������֮����B��D��Ԫ��ԭ�Ӻ���������֮�͵ģ�C��D��E����Ԫ�صĻ�̬ԭ�Ӿ�����ͬ�ĵ��Ӳ�������Eԭ�ӵ�p����ϵ�������Dԭ�ӵ�p����϶�һ�����ӣ�6��Ԫ�صĻ�̬ԭ���У�Fԭ�ӵĵ��Ӳ�������Һ�A����ͬһ���塣�ش���������:
��1���õ���ʽ��ʾC��E�γɻ�����Ĺ�����
��2��д����̬Fԭ�ӵĺ�������Ų�ʽ��
��3��д��A2D�ĵ���ʽ �� �������(���������������ͬ)������������
��4��A��B��C��ͬ�γɵĻ������л�ѧ������������
���𰸡�
��1��![]()
��2��1s22s22p63s23p64s1
��3��![]() ����������
����������
��4�����Ӽ������ۼ�
����������֪BԪ���ǵؿ��к�������Ԫ�أ���BΪ��Ԫ�أ�B��D�ļ۵�������ͬ����DΪ��Ԫ�أ�B��D��Ԫ��ԭ�Ӻ���������֮��Ϊ24����Ϊ12��A��C�ļ۵�������ͬ����A��C��Ԫ��ԭ�Ӻ��������֮����B��D��Ԫ��ԭ�Ӻ���������֮�͵�һ�룬��AΪ��Ԫ�أ�CΪ��Ԫ�أ�C��D��E����Ԫ�صĻ�̬ԭ�Ӿ�����ͬ�ĵ��Ӳ�������Eԭ�ӵ�p����ϵ�������Dԭ�ӵ�p����϶�һ�����ӣ���EΪ��Ԫ�أ�6��Ԫ�صĻ�̬ԭ���У�Fԭ�ӵĵ��Ӳ�������Һ�A����ͬһ���壬��FΪ��Ԫ�ء�

 �Ķ��쳵ϵ�д�
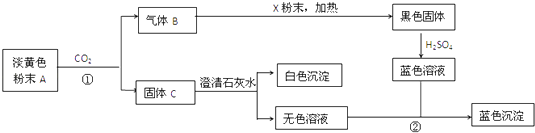
�Ķ��쳵ϵ�д�����Ŀ��2013�������������������ص����������������ǵij��м���������˼����Σ�����о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
��1�������Ƽ�ѭ�������ѳ������е�SO2 �� �����Ƽ�ѭ�����У�Na2SO3��Һ��Ϊ����Һ������NaOH��Һ����SO2�Ƶã��÷�Ӧ�����ӷ���ʽ�� ��
������Һ����SO2�Ĺ����У�pH��n��SO32������n��HSO3�����仯��ϵ���±���
n��SO32������n��HSO3���� | 91��9 | 1��l | 9��91 |
pH | 8.2 | 7.2 | 6.2 |
���ϱ��жϣ�NaHSO3��Һ���ԣ���ᡱ��������С������û�ѧƽ��ԭ�����ͣ� ��
�۵�����Һ��pH����ԼΪ6ʱ����������������������ʾ��ͼ���£�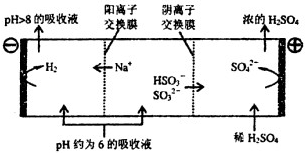
д��HSO3���������ŵ�ĵ缫��Ӧʽ�� �� ������������ҺpH����8����ʱ������Һ������ѭ�����ã�
��2����CH4����ԭNOx�������������������Ⱦ�����磺 CH4��g��+4NO2��g���T4NO��g��+CO2��g��+2H2O��g������H=��574kJmol��1
CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2O��g������H=��1160kJmol��1
���ñ�״����4.48L CH4��ԭNO2��N2 �� ����������ת�Ƶĵ�������Ϊ������٤��������ֵ��NA��ʾ�����ų�������ΪkJ��
��3����ҵ�Ϻϳɵ������������Ʊ������У����е�һ����ӦΪ��CO��g��+H2O��g�� ![]() CO2��g��+H2��g������H��0 һ�������£���CO��g����H2O��g���������Ϊ1��2�����ܱ������з���������Ӧ���ﵽƽ��ʱ���CO��g����H2O��g�������Ϊ1��6����ƽ�ⳣ��K= ��
CO2��g��+H2��g������H��0 һ�������£���CO��g����H2O��g���������Ϊ1��2�����ܱ������з���������Ӧ���ﵽƽ��ʱ���CO��g����H2O��g�������Ϊ1��6����ƽ�ⳣ��K= ��