题目内容
室温下,往0.1mol/L的氨水中滴入酚酞试液时,溶液将呈现粉红色。现采取下列措施,滴有酚酞的氨水溶液颜色不会变浅的是
| A.往溶液中滴入稀硫酸 | B.往溶液中加入NH4Cl晶体 |
| C.把溶液加热至沸腾 | D.往溶液中加入NaOH固体 |
D
试题分析:氨水是弱碱存在电离平衡,即NH3·H2O
 OH-+NH4+。往溶液中滴入稀硫酸,促进电离,但溶液的碱性降低,颜色变浅。往溶液中加入NH4Cl晶体,抑制氨水的电离,溶液的碱性降低,颜色变浅。把溶液加热至沸腾,氨水分解,氨气溢出,溶液的碱性降低,颜色变浅。往溶液中加入NaOH固体,抑制氨水的电离,但溶液的碱性增强,颜色变深,答案选D。
OH-+NH4+。往溶液中滴入稀硫酸,促进电离,但溶液的碱性降低,颜色变浅。往溶液中加入NH4Cl晶体,抑制氨水的电离,溶液的碱性降低,颜色变浅。把溶液加热至沸腾,氨水分解,氨气溢出,溶液的碱性降低,颜色变浅。往溶液中加入NaOH固体,抑制氨水的电离,但溶液的碱性增强,颜色变深,答案选D。点评:该题是基础性试题的考查,难度不大。主要是考查学生对氨水电离平衡以及外界条件对氨水电离平衡影响的了解掌握情况,有利于培养学生的逻辑推理能力和发散思维能力。

练习册系列答案
相关题目
 Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是: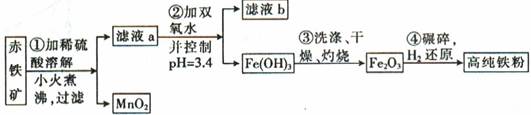

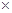 10-20,该温度下反应:Cu2++2H2O
10-20,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。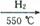 FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。
FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。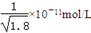
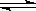 Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是