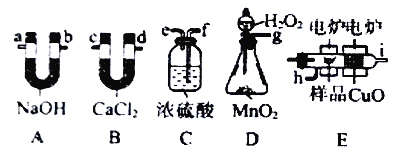
��Ŀ����
����Ŀ��������������Ҫ�ķ�������ij��ѧ��ȤС����̼��Ũ����Ϊ��ʼԭ�ϣ��������װ������һ��������������Ʒ�Ӧ�Ʊ��������ƣ����г�װ�ú�A�м���װ�����ԣ��������Ѽ��飩 
�������ϣ���HNO2Ϊ���ᣬ�����´��ڷ�Ӧ3HNO2�THNO3+2NO��+H2O��
��NO����Ӧ���ɱ�����KMnO4��Һ����Ϊ���ᡣ
ʵ��������ٹرյ��ɼУ���A�з�Һ©���������μ�һ����Ũ���ᣬ���ȣ�
��һ��ʱ���ֹͣ���ȡ�
(1)A�з�Ӧ�Ļ�ѧ����ʽ��_________________________________________��
(2)B�й۲쵽����Ҫ������_______________________��Dװ�õ�������___________________��
(3)ʵ�龭�Ľ�����Ƶýϴ��������ƣ����й����������Ƶ�˵����ȷ����________��
a��������������ζ���ɴ���ʳ��ʳ��
b�������£�0.1mol/L��������ҺpH=1
c��0.1mol/L����������Һ�д��ڣ�c��Na+��+c��H+��=c��NO2����+c��OH����
d��0.1mol/L����������Һ�д��ڣ�c��NO2������c��Na+����c��OH������c��H+��
���𰸡� C+4HNO3��Ũ��![]() CO2��+4NO2��+2H2O ��Һ������ͭƬ�ܽ⣬���ܿ�����ɫ����ð�� ��ȥδ��Ӧ��NO����ֹ��Ⱦ���� c
CO2��+4NO2��+2H2O ��Һ������ͭƬ�ܽ⣬���ܿ�����ɫ����ð�� ��ȥδ��Ӧ��NO����ֹ��Ⱦ���� c
�����������⿼��ʵ�鷽����������ۣ���1��A������Ũ�����ǿ�����ԣ���̼������Ӧ���䷴Ӧ����ʽΪC��4HNO3(Ũ) ![]() CO2����4NO2����2H2O����2��A�в�����NO2������Bװ�ã�����3NO2��H2O=2HNO3��NO��Cu��ϡ���ᷢ����3Cu��8HNO3=3Cu(NO3)2��2NO����4H2O���۲쵽B��������ͭƬ�ܽ⣬��Һ��Ϊ��ɫ�����ܿ�����ɫ�����������ΪNO�ж���Ϊ��ֹ��Ⱦ����������β��������������Ϣ��NO�������Ը��������Һ������Ӧ����������HNO3�����װ��D�������dz�ȥδ��Ӧ��NO����ֹ��Ⱦ��������3��a���������ξ����°��ԣ����ܴ���ʳ��ʹ�ã���a����b���������������ᣬ������0.1mol��L��1HNO2��Һ��pH>1����b����c�����ݵ���غ㣬c(Na��)��c(H��)=c(NO2��)��c(OH��)����c��ȷ��d��������������ǿ�������Σ�NO2������ˮ�⣺NO2����H2O
CO2����4NO2����2H2O����2��A�в�����NO2������Bװ�ã�����3NO2��H2O=2HNO3��NO��Cu��ϡ���ᷢ����3Cu��8HNO3=3Cu(NO3)2��2NO����4H2O���۲쵽B��������ͭƬ�ܽ⣬��Һ��Ϊ��ɫ�����ܿ�����ɫ�����������ΪNO�ж���Ϊ��ֹ��Ⱦ����������β��������������Ϣ��NO�������Ը��������Һ������Ӧ����������HNO3�����װ��D�������dz�ȥδ��Ӧ��NO����ֹ��Ⱦ��������3��a���������ξ����°��ԣ����ܴ���ʳ��ʹ�ã���a����b���������������ᣬ������0.1mol��L��1HNO2��Һ��pH>1����b����c�����ݵ���غ㣬c(Na��)��c(H��)=c(NO2��)��c(OH��)����c��ȷ��d��������������ǿ�������Σ�NO2������ˮ�⣺NO2����H2O![]() HNO2��OH������������ˮ��Һ�Լ��ԣ��������Ũ�ȴ�С˳����c(Na��)>c(NO2��)>c(OH��)>c(H��)����d����
HNO2��OH������������ˮ��Һ�Լ��ԣ��������Ũ�ȴ�С˳����c(Na��)>c(NO2��)>c(OH��)>c(H��)����d����

����Ŀ����1����2L�����ܱ������У�������Ӧ2NO��g��+O2��g��2NO2��g����
��ij�¶�ʱ�������ʵ�����2��1����NO��O2��ʼ��Ӧ��n��NO����ʱ��仯�����
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO����mol�� | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
0��4s����O2Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ________��
����˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
A��������ɫ���ֲ��� B������ƽ����Է����������ֲ���
C��������NO��=2������O2�� D������ѹǿ���ֲ���
����֪��K300�棾K400�森���д�ʩ��ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����_______��
A�������¶� B������Arʹѹǿ����
C��ѡ���Ч���� D������NOʹѹǿ����
��2������ȼ�ϵ�ؿ����������������ʣ���ͼ�����ü���ȼ�ϵ�ص��100ml 1mol/Lʳ��ˮ�����һ��ʱ����ռ�����״���µ�����2.24L���������Һ������䣩��
�ټ���ȼ�ϵ�صĸ�����Ӧʽ��____________________________________________��
�ڵ�����Һ��pH=________����������������������Һ��Ӧ����
��3���ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ�����ײʱ�ſ��ܷ�����ѧ��Ӧ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λͨ����kJ/mol��ʾ��������۲���ͼ��Ȼ��ش����⣺

������3����Ӧ�з���ʾ��ͼ�����ķ�Ӧ���� ___________������ţ���
A��������Fe2O3��Ӧ B����ˮϡ��Ũ������Һ C�����ȵ�̼��CO2��Ӧ
���Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ������֪��
CH4��g��+H2O��g��=CO��g��+3H2��g����H=+306kJ/mol
CH4��g��+CO2��g��=2CO��g��+2H2��g����H=+240kJ/mol
CH4��g����H2O��g����Ӧ����CO2��g����H2��g�����Ȼ�ѧ����ʽΪ_______________________��