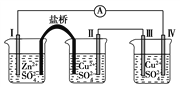
题目内容
【题目】从海带中提取碘的工业生产过程如下:
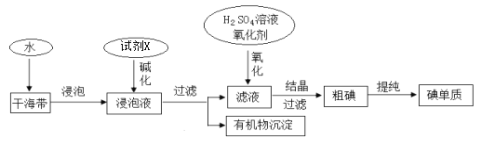
下列说法不正确的是
A.试剂X可以为NaOH溶液,其作用是使浸泡液中的可溶性有机物形成沉淀
B.氧化剂X可以用H2O2或适量的Cl2
C.干海带浸泡液中的碘离子可用淀粉溶液检验
D.氧化后的滤液在实验室也可采用四氯化碳萃取、分液、蒸馏的方法得到粗碘,蒸馏后得到的粗碘在蒸馏烧瓶中
【答案】C
【解析】
从海带中提取碘:海带浸泡后加碱进行碱化,过滤得到有机沉物,滤液加入氧化剂和稀硫酸氧化碘离子为碘单质,得到含碘水溶液,加入有机溶剂,萃取分液得到含碘的有机溶液,通过蒸馏得到碘单质,据此分析作答。
A. 由于操作①后得到有机物沉淀,则加入NaOH溶液的目的是使可溶性有机质形成沉淀,A项正确;
B. 氯气氧化性强于单质碘,H2O2常做绿色氧化剂,因此氧化剂X可以用H2O2或适量的Cl2,B项正确;
C. 淀粉溶液与碘单质反应变蓝色,而不是碘离子,因此干海带浸泡液中的碘离子不能用淀粉溶液检验,C项错误;
D. 氧化后的滤液为碘水溶液,因碘易溶于有机溶剂,且易升华,因此在实验室可采用四氯化碳萃取、分液、蒸馏的方法得到粗碘,蒸馏后得到的粗碘在蒸馏烧瓶中,D项正确;
答案选C。

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目