题目内容
【题目】在周期表中1-36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子,Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态。
(1)按电子排布,Q元素在周期表中属 区。
(2)第一电离能Y Z,电负性Y Z(填“>”“<”或“=”)。
(3)W与Z形成的常见化合物有W2Z、W2Z2,W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6……,W2Z分子中Z原子的杂化类型为 ,YW3分子的立体构型为 ,YW3极易溶于W2Z的主要原因有 。
(4)若向含有Q2+的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,该晶体阳离子中含有的化学键有 。
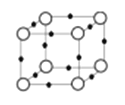
(5)Q+与Y3-形成的晶胞结构如图所示。阴、阳离子间的核间距为a pm,阿伏伽德罗常数用NA表示,则晶体的密度为 g/cm3.
【答案】
(1)ds;(2)>;<;
(3)sp3杂化;三角锥形;都是极性分子,相似相溶;NH3与H2O分子间可形成氢键;NH3与H2O 反应;
(4)配位键、极性键;(5)![]() g·cm-3
g·cm-3
【解析】
试题分析:在周期表中1-36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,X为C元素,则W为H元素;Y元素原子的最外层有3个自旋方向相同的未成对电子,Y为N元素;Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子,Z为O元素,Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态,Q为Cu元素。
(1)Cu元素的价电子排布为3d104s1,在周期表中属ds区,故答案为:ds;
(2)N元素的原子2p为半充满结构,较为稳定,第一电离能N>O;元素的非金属性越强,电负性数值越大,N<O,故答案为:> ;<;
(3)H与O形成的常见化合物有H2O、H2O2,在H2O分子中O原子的价层电子对数=2+![]() (6-2×1)=4,采取sp3杂化;NH3分子中N原子采取sp3杂化,立体构型为三角锥形;氨气分子和水分子都是极性分子,相似相溶或者NH3与H2O分子间可形成氢键或者NH3与H2O 反应,都造成氨气极易溶于水,故答案为:sp3杂化;三角锥形;都是极性分子,相似相溶(或NH3与H2O分子间可形成氢键或NH3与H2O 反应);
(6-2×1)=4,采取sp3杂化;NH3分子中N原子采取sp3杂化,立体构型为三角锥形;氨气分子和水分子都是极性分子,相似相溶或者NH3与H2O分子间可形成氢键或者NH3与H2O 反应,都造成氨气极易溶于水,故答案为:sp3杂化;三角锥形;都是极性分子,相似相溶(或NH3与H2O分子间可形成氢键或NH3与H2O 反应);
(4)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,再向深蓝色透明溶液加入乙醇,由于乙醇极性比水小,[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以会析出深蓝色的晶体Cu(NH3)4SO4H2O,Cu(NH3)4SO4H2O中存在配位键、极性键,故答案为:配位键、极性键;
(5)Cu+与N3-形成的晶胞结构如图所示,则晶胞边长为2acm,该晶胞中灰色球个数=8×![]() =1、黑色球个数=12×
=1、黑色球个数=12×![]() =3,根据化合价知,灰色球表示氮离子、黑色球表示亚铜离子,与同一个N3-相连的Cu+有6个,该晶体的密度=
=3,根据化合价知,灰色球表示氮离子、黑色球表示亚铜离子,与同一个N3-相连的Cu+有6个,该晶体的密度=![]() =
=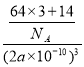 gcm-3=
gcm-3=![]() gcm-3,故答案为:
gcm-3,故答案为:![]() 。
。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】A~H均为短周期元素,A~F在元素周期表中的相对位置如下图所示,G与其它七种元素不在同一周期,H是短周期中原子半径最大的主族元素。由B、G组成的气态化合物甲水溶液呈碱性。
A | B | C | |
D | E | F |
请回答下列问题:
(1)写出甲的电子式,实验室制取气体甲的化学方程式为。
(2)B、C、G个数比为1:1:5形成的化合物的化学键类型为。
A.离子键
B.极性键
C.非极性键
(3)请用电子式表示AE2的形成过程。
(4)用离子符号表示C、E、F、H四种离子的半径由大到小的顺序。
(5)用一个离子方程式解释A比D非金属性强的原因。