题目内容
(2012?保定一模)双氧水常用作消毒、杀菌、漂白等.现有1OOmL一定浓度的双氧水试样.甲同学想用下列实验装置,设计一个简单实验,测定双氧水试样的物质的量浓度(可供选用的试剂还有MnO2固体).
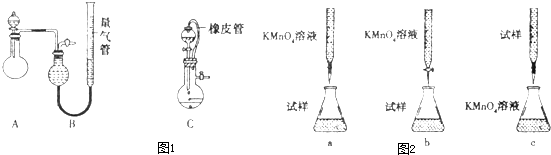
请回答下列问题:
(1)使用B装置测量产生的气体体积(图1),读数时应注意的问题①
②上下移动量气管使管内液面与球形容器内液面相平;③
(2)乙同学认为使用装置A、B测量产生的气体体积有误差,会使测量的气体体积偏大,该同学建议用C装置替代A装置,这样做的目的是①
(3)在相同的温度和压强下,如果1OOmL物质的量浓度为1mol?L-1的双氧水,在催化剂作用下完全分解产生气体的体积为a L,而该实验过程中试样完全分解产生的气体体积为bL.试用含a、b的代数式表示出该试样的物质的量浓度
mol/L
mol/L
(4)若用酸性KMnO4标准溶液滴定双氧水试样,请回答下列问题:
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯外,还需的仪器是
②某同学设计的滴定方式(图2),最合理的是

请回答下列问题:
(1)使用B装置测量产生的气体体积(图1),读数时应注意的问题①
恢复到室温后测量气体体积
恢复到室温后测量气体体积
,②上下移动量气管使管内液面与球形容器内液面相平;③
应保持视线与量气管内凹液面最低点相切
应保持视线与量气管内凹液面最低点相切
.(2)乙同学认为使用装置A、B测量产生的气体体积有误差,会使测量的气体体积偏大,该同学建议用C装置替代A装置,这样做的目的是①
平衡气压使分液漏斗内的液体能顺利滴下
平衡气压使分液漏斗内的液体能顺利滴下
;②避免因分液漏斗内液体进入烧瓶引起气体体积测量误差
避免因分液漏斗内液体进入烧瓶引起气体体积测量误差
(3)在相同的温度和压强下,如果1OOmL物质的量浓度为1mol?L-1的双氧水,在催化剂作用下完全分解产生气体的体积为a L,而该实验过程中试样完全分解产生的气体体积为bL.试用含a、b的代数式表示出该试样的物质的量浓度
| b |
| a |
| b |
| a |
(4)若用酸性KMnO4标准溶液滴定双氧水试样,请回答下列问题:
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯外,还需的仪器是
胶头滴管,250 mL容量瓶
胶头滴管,250 mL容量瓶
.②某同学设计的滴定方式(图2),最合理的是
b
b
(夹持部分略去,填字母序号),滴定至终点时的现象是滴入一滴高锰酸钾溶液,溶液恰好呈浅红色,且30秒内不褪色
滴入一滴高锰酸钾溶液,溶液恰好呈浅红色,且30秒内不褪色
.分析:(1)对量气管读数时,首先等实验装置恢复到室温再进行下一步操作,然后调节量气管使左右液面相平,最后读数时视线与凹液面最低处相平;
(2)依据装置特征分析,导管起到平衡压强作用使液体顺利流下,避免分液漏斗中的液体流入影响测定结果;
(3)相同条件下过氧化氢分解生成氧气的体积比等于过氧化氢物质的量之比计算;
(4)①依据溶液配制的步骤和过程分析判断需要的仪器;
②依据高锰酸钾溶液、过氧化氢具 有强氧化性腐蚀橡胶管分析.
(2)依据装置特征分析,导管起到平衡压强作用使液体顺利流下,避免分液漏斗中的液体流入影响测定结果;
(3)相同条件下过氧化氢分解生成氧气的体积比等于过氧化氢物质的量之比计算;
(4)①依据溶液配制的步骤和过程分析判断需要的仪器;
②依据高锰酸钾溶液、过氧化氢具 有强氧化性腐蚀橡胶管分析.
解答:解:(1)依据PV=nRT,为保证测出来的气体体积是当时大气压下的体积,在读数时应注意:①将实验装置恢复到室温,②使量气管两端液面相平,因为相平说明两边液面上的压强是一样的,这样测出来的气体体积才是当时大气压下的体积,③视线与凹液面最低处相平,俯视或仰视会造成误差,
故答案为:恢复到室温后测量气体体积;应保持视线与量气管内凹液面最低点相切;
(2)使用装置A、B测量产生的气体体积有误差,会使测量的气体体积偏大,该同学建议用C装置替代A装置,目的是平衡压强使液体顺利流下,避免过程中产生误差;①平衡气压使分液漏斗内的液体能顺利滴下;②避免因分液漏斗内液体进入烧瓶引起气体体积测量误差,
故答案为:平衡气压使分液漏斗内的液体能顺利滴下,避免因分液漏斗内液体进入烧瓶引起气体体积测量误差;
(3)如果1OOmL物质的量浓度为1mol?L-1的双氧水,在催化剂作用下完全分解产生气体的体积为a L,而该实验过程中试样完全分解产生的气体体积为bL,
2H2O2=2H2O+O2
0.1mol aL
n bL
n=
mol
过氧化氢浓度=
=
mol/L,
故答案为:
mol/L;
(4)①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯外,还需的仪器是定容需要的胶头滴管,配制溶液需要的250ml的容量瓶,
故答案为:胶头滴管;250ml容量瓶;
②高锰酸钾溶液和过氧化氢具有强氧化性能氧化碱式滴定管中的橡胶管,所以b装置符合要求;反应到终点的现象可以依据高锰酸钾溶液紫红色变化分析,当滴入最后一滴高锰酸钾溶液,溶液恰好呈浅红色且半分钟不变化,证明反应 达到终点,
故答案为:b;滴入一滴高锰酸钾溶液,溶液恰好呈浅红色,且30秒内不褪色.
故答案为:恢复到室温后测量气体体积;应保持视线与量气管内凹液面最低点相切;
(2)使用装置A、B测量产生的气体体积有误差,会使测量的气体体积偏大,该同学建议用C装置替代A装置,目的是平衡压强使液体顺利流下,避免过程中产生误差;①平衡气压使分液漏斗内的液体能顺利滴下;②避免因分液漏斗内液体进入烧瓶引起气体体积测量误差,
故答案为:平衡气压使分液漏斗内的液体能顺利滴下,避免因分液漏斗内液体进入烧瓶引起气体体积测量误差;
(3)如果1OOmL物质的量浓度为1mol?L-1的双氧水,在催化剂作用下完全分解产生气体的体积为a L,而该实验过程中试样完全分解产生的气体体积为bL,
2H2O2=2H2O+O2
0.1mol aL
n bL
n=
| 0.1b |
| a |
过氧化氢浓度=
| ||
| 0.1 |
| b |
| a |
故答案为:
| b |
| a |
(4)①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯外,还需的仪器是定容需要的胶头滴管,配制溶液需要的250ml的容量瓶,
故答案为:胶头滴管;250ml容量瓶;
②高锰酸钾溶液和过氧化氢具有强氧化性能氧化碱式滴定管中的橡胶管,所以b装置符合要求;反应到终点的现象可以依据高锰酸钾溶液紫红色变化分析,当滴入最后一滴高锰酸钾溶液,溶液恰好呈浅红色且半分钟不变化,证明反应 达到终点,
故答案为:b;滴入一滴高锰酸钾溶液,溶液恰好呈浅红色,且30秒内不褪色.
点评:本题考查了高锰酸钾溶液、过氧化氢性质的分析,物质性质的实验探究方法和操作步骤分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目