题目内容
18.有一份无色溶液,只可能有Na+、Cl-、H+、SO42-、CO32-、Cu2+、NO3- 中的几种(忽略水电离产生的少量的OH-).取该溶液检测,发现溶液显强酸性.(1)不需要进一步实验,可以判断,溶液中一定存在H+,一定不存在CO32-、Cu2+
(2)进一步测定,发现该溶液中C(H+)=0.1mol/L.取100ml 该溶液,加入足量BaCl2,生成2.33g沉淀,过滤,滤液中加入足量AgNO3溶液,产生5.74g 沉淀.100ml溶液中是否有Cl-可能有 (填一定有、一定没有、可能有),100ml 溶液中Na+ 的物质的最浓度至少为0.1mol/L.
分析 (1)溶液为无色,则一定不存在有色的离子Cu2+,显强酸性,存在H+,则不存在CO32-;
(2)加入足量BaCl2,生成2.33g沉淀,说明含有SO42-,根据硫酸钡计算氯化钡和氯离子,然后结合AgCl的物质的量判断是否含有氯离子;根据电荷守恒计算钠离子.
解答 解:(1)溶液为无色,则一定不存在有色的离子Cu2+,显强酸性,存在H+,则不存在CO32-,所以不需要进一步实验,可以判断,溶液中一定存在H+;一定不存在CO32-、Cu2+;
故答案为:H+;CO32-、Cu2+;
(2)加入足量BaCl2,生成2.33g沉淀,说明含有SO42-,硫酸钡的物质的量为$\frac{2.33g}{233g/mol}$=0.01mol,则BaCl2为0.01mol,Cl-为0.02mol,已知滤液中加入足量AgNO3溶液,产生5.74g 沉淀,则AgCl的物质的量为$\frac{5.74g}{143.5g/mol}$=0.04mol,则与银离子反应的氯离子的物质的量为0.04mol,所以原来溶液中可能含有Cl-;已知硫酸根离子为0.01mol,则其浓度为$\frac{0.01mol}{0.1L}$=0.1mol/L,电荷守恒:c(Na+)+c(H+)=2c(SO42-)可知,c(Na+)=0.1mol/L,由于可能含有氯离子,所以Na+ 的物质的最浓度至少为0.1mol/L;
故答案为:可能有;0.1.
点评 本题考查了常见离子的检验方法,题目难度中等,采用定性实验和定量计算分析相结合的模式,增大了解题难度,同时涉及离子共存、离子反应等都是解题需注意的信息.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
16.下列分离与提纯的方法不正确的是( )
| A. | 除去氯化钠溶液中的泥沙可以使用过滤的方法 | |
| B. | 提取溴水中的溴单质用四氯化碳萃取 | |
| C. | 从含有少量氯化钠的硝酸钾溶液中提取硝酸钾可以使用结晶的方法 | |
| D. | 分离汽油和水使用蒸馏的方法 |
9.下列叙述正确的是( )
| A. | SO2具有漂白性,能使碘的淀粉溶液由蓝色变为无色 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 少量金属钠通常保存在煤油中,着火时可用细沙覆盖灭火 | |
| D. | 实验室中用石灰水区分Na2CO3与NaHCO3两瓶无标签溶液 |
13.下列离子方程式正确的是( )
| A. | 等物质的量的Ba(OH)2和Ba ( HCO3)2 溶于足量水中发生反应:Ba2++2HCO${\;}_{3}^{-}$+2OH-═BaCO3↓+2H2O+CO${\;}_{3}^{2-}$ | |
| B. | NaOH 溶液中滴加少量的Ca(HCO3)2溶液:OH-+Ca2++HCO${\;}_{3}^{-}$═CaCO3↓+H2O | |
| C. | 稀氨水溶液与醋酸的反应:NH3•H2O+CH3COOH═CH3COO-+NH${\;}_{4}^{+}$+H2O | |
| D. | 大理石中滴入硫酸:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O |
3.元素的种类和原子的种类相比较( )
| A. | 前者多 | B. | 后者多 | C. | 相等 | D. | 不能确定 |
7.设NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下22.4LH2O中含分子数为NA | |
| B. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | 常温常压下,1mol氦气含有2NA个原子 | |
| D. | 1molHCl气体溶于1L水中形成的盐酸中含有NA个HCl分子 |
8.下列烷烃的系统命名中,错误的是( )
| A. | 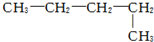 戊烷 戊烷 | B. | 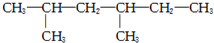 2,4-甲基乙烷 2,4-甲基乙烷 | ||
| C. | 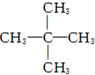 2,2-二甲基丙烷 2,2-二甲基丙烷 | D. |  4-甲基戊烷 4-甲基戊烷 |