题目内容
某化学兴趣小组的同学用如图所示装置研究电化学问题。当闭合该装置的电键时,观察到电流计的指针发生偏转。下列有关说法错误的是
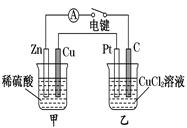

| A.甲装置是原电池,乙装置是电解池 |
| B.当甲中产生0.1 mol气体时,乙中析出固体的质量为6.4 g |
| C.实验一段时间后,甲烧杯中溶液的pH增大 |
| D.将乙中的C电极换成铜电极,则乙装置可变成电镀装置 |
D
试题分析:A、锌与稀硫酸反应生成硫酸锌与氢气,属于自发的氧化还原反应,即甲装置是原电池,其中锌是负极,铜是正极。乙装置是电解池,其中碳棒是阴极,Pt电极是阳极,A正确;B、甲中产生的气体是氢气,0.1mol氢气转移0.2mol电子,则依据电子守恒可知乙装置中析出铜的物质的量是0.1mol,质量是6.4g,B正确;C、甲装置中氢离子放电,溶液的酸性降低,因此实验一段时间后,甲烧杯中溶液的pH增大,C正确;D、乙装置中碳棒是阴极,因此将乙中的C电极换成铜电极,乙装置不能变成电镀装置,因为电镀装置中镀层金属应该作阳极,D不正确,答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 2H2O
2H2O Li2O2,下列有关说法正确的是( )
Li2O2,下列有关说法正确的是( )
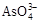 +2I-+2H+
+2I-+2H+
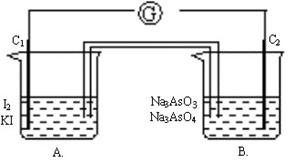
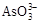 +I2+H2O,设计如下图所示实验装置。B烧杯中装有Na3AsO4和Na3AsO3溶液,A烧杯中装有I2和KI溶液。两烧杯中用一倒置的装有饱和KI溶液的U型管相连,该装置称为盐桥,其作用是避免两烧杯中的溶液相混合,又能使两烧杯中的溶液因相连通而导电。C1、C2棒为惰性电极。进行如下操作:
+I2+H2O,设计如下图所示实验装置。B烧杯中装有Na3AsO4和Na3AsO3溶液,A烧杯中装有I2和KI溶液。两烧杯中用一倒置的装有饱和KI溶液的U型管相连,该装置称为盐桥,其作用是避免两烧杯中的溶液相混合,又能使两烧杯中的溶液因相连通而导电。C1、C2棒为惰性电极。进行如下操作: