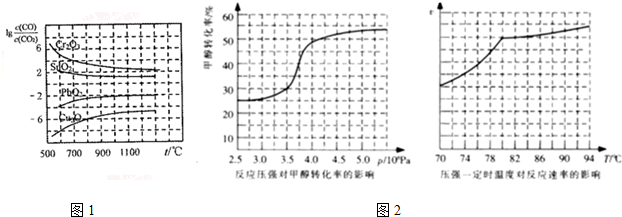
题目内容
19.HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐═较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量)═A-+H2C-B.H2B(少量)+2A-═B2-+2HA
C.H2B(少量)+H2C-═HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是H2B.
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是C3-,最难结合质子的是HB-.
(3)完成下列反应的离子方程式HA(过量)+C3-:2HA(过量)+C3-=H2C-+2A-.
分析 先根据题目中的信息,判断酸性顺序:第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度,得到
H2B>HB-、H3C>H2C->HC2-,它们之间能发生下列反应,得到
①HA+HC2-(少量)=A-+H2C-
即HA>H2C-,同时,即使HA过量,也只能生成H2C-,而不是H3C,说明HA<H3C,
②H2B(少量)+2A-=2HA+B2-
即H2B>HA,同时,由于H2B很少,并生成B2-,即说明H2B将2个H+都给了A-,即HB-也能将H+给A-,
即说明H2B>HB->HA
③H2B(少量)+H2C-=HB-+H3C
即H2B>H3C,但是生成HB-,即说明HB-不能将H+提供,即HB-<H3C,即H2B>H3C>HB-
综合,得到H2B>H3C>HB->HA>H2C->HC2-
然后利用这个顺序进行判断.
解答 解:(1)根据题目中的信息,判断酸性顺序:第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度,得到
H2B>HB-H3C>H2C->HC2-它们之间能发生下列反应,
①HA+HC2-(少量)=A-+H2C-,即HA>H2C-,同时,即使HA过量,也只能生成H2C-,而不是H3C,说明HA<H3C,
②H2B(少量)+2A-=2HA+B2-,即H2B>HA,同时,由于H2B很少,并生成B2-,即说明H2B将2个H+都给了A-,即HB-也能将H+给A-,
即说明H2B>HB->HA,
③H2B(少量)+H2C-=HB-+H3C,
即H2B>H3C,但是生成HB-,即说明HB-不能将H+提供,即HB-<H3C,即H2B>H3C>HB-,
综合信息得到H2B>H3C>HB->HA>H2C->HC2-,所以最强的酸为H2B,故答案为:H2B;
(2)由以上酸性强弱顺序知:物质的酸性越强,其对应酸根离子结合质子的能力越弱,反之越强,所以最易结合质子的是C3-,最难结合质子的是HB-.
故答案为:C3-;HB-;
(3)根据H2B>H3C>HB->HA>H2C->HC2-,过量HA与C3-反应生成H2C-与2A-,反应的离子方程式为2HA(过量)+C3-═H2C-+2A-,
故答案为:2HA(过量)+C3-═H2C-+2A-.
点评 本题综合考查弱电解质的电离问题,题目难度中等,做题时注意把握“较强酸+较弱酸盐→较强酸盐+较弱酸”的反应规律,侧重于考查学生的分析能力和对题干信息的应用能力.

| A. | 由Ga与铝位于同一主族可知Ga既能与盐酸反应又能与氢氧化钠反应 | |
| B. | AsH3的稳定性弱于PH3 | |
| C. | Ga的原子序数比Ca大1 | |
| D. | 太阳能电池属于原电池 |
| A. | 向澄清石灰水中加入等物质的量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| B. | 向NH4HSO4稀溶液中加入NaOH稀溶液少量:OH-+NH4+═NH3•H2O | |
| C. | 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 向淀粉KI溶液中滴加酸性H2O2溶液,溶液变蓝色:H2O2+2I-+2H+═I2+2H2O |
| A. | v(N2)=0.25mol•L-1•min-1 | B. | v(H2)=0.0125 mol•L-1•s-1 | ||
| C. | v(NH3)=1.0 mol•L-1•min-1 | D. | v(H2)=0.75 mol•L-1•min-1 |
| A. | 在4mL0.1mol/L的K2Cr2O7溶液中滴加数滴1mol/LNaOH溶液,溶液颜色从橙色变成黄色 | |
| B. | 向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 | |
| C. | 在试管中加入少量氯化钴晶体,滴加浓盐酸溶解后加水稀释至紫色,将试管置于热水中片刻,溶液颜色变成粉红色 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),从针筒顶端观察,气体颜色逐渐变浅 |
| A. | CH4+2O2=CO2+2H2O | B. | C+H2O(气)=CO+H2 | ||
| C. | Cu2(OH)2CO3=2CuO+CO2↑+H2O | D. | FeCl3+3NaOH=Fe(OH)3↓+3NaCl |
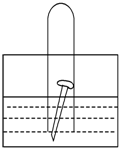 如图所示,水槽中的试管内有一枚铁钉,放置数天观察.
如图所示,水槽中的试管内有一枚铁钉,放置数天观察.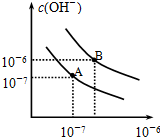 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: