题目内容
(9分)亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:
Na2SO3+KIO3+H2SO4 ==Na2SO4+K2SO4+I2+H2O,
(1)其中氧化剂是 ,若反应中有5mol电子转移,则生成碘是________mol。
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢) ②IO2-+ SO32-→IO-+SO42-(快)
③5I-+6H++ IO3-→3I2+3H2O(快) ④I2+ SO32-+ H2O→2I-+ SO42-+2H2(快)
(2)根据上述条件推测,此反应的总的反应速率由 步反应决定。
Na2SO3+KIO3+H2SO4 ==Na2SO4+K2SO4+I2+H2O,
(1)其中氧化剂是 ,若反应中有5mol电子转移,则生成碘是________mol。
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢) ②IO2-+ SO32-→IO-+SO42-(快)
③5I-+6H++ IO3-→3I2+3H2O(快) ④I2+ SO32-+ H2O→2I-+ SO42-+2H2(快)
(2)根据上述条件推测,此反应的总的反应速率由 步反应决定。
(1)KIO3;0.5(2)①
(1)根据方程式可知,碘酸钾中碘元素的化合价从+5价降低到0价,得到5个电子,所以碘酸钾是氧化剂;如果转移5mol电子,则生成碘单质是0.5mol。
(2)根据反应过程和机理可知,该反应的反应速率决定于反应速率最慢的那一步,所以答案选①.
(2)根据反应过程和机理可知,该反应的反应速率决定于反应速率最慢的那一步,所以答案选①.

练习册系列答案
相关题目
 4C(g) +5D(g)。若经5s后,剩下的A是2.5mol,则B的反应速率是( )
4C(g) +5D(g)。若经5s后,剩下的A是2.5mol,则B的反应速率是( ) 2C(g)+D(g),经2min,B的浓度减少0.6 mol?L-1。对此反应速率的表示,正确的是
2C(g)+D(g),经2min,B的浓度减少0.6 mol?L-1。对此反应速率的表示,正确的是 两种气体通入密闭容器中,反应按
两种气体通入密闭容器中,反应按
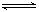
 进行,2秒钟后反应速率如下:
进行,2秒钟后反应速率如下: ,
,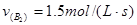 ,
,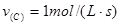 ,则x、y的值分别为( )
,则x、y的值分别为( ) 2C+2D,在四种不同的情况下的反应速率分别为:
2C+2D,在四种不同的情况下的反应速率分别为: 2C(g),反应2 s后测得C的浓度为0.6 mol/L。下列说法正确的是
2C(g),反应2 s后测得C的浓度为0.6 mol/L。下列说法正确的是