��Ŀ����
����Ŀ��A��B��C��D��E��FΪԭ�������������������Ԫ�ء���֪��A�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�B�Ļ�̬ԭ�Ӻ��������7���˶�״̬��B��C��E����Ԫ��ԭ����δ�ɶԵ�����֮��Ϊ3��2��1��Dԭ�Ӻ�����4���ܼ��Ҿ��������ӣ�D��E���γ�DE2�ͻ����Fԭ�Ӻ��������ֻ��1�����ӣ����������������ӡ�
�ش��������⣺
��1��B��C��D����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ (��Ԫ�ط��ű�ʾ)
��2��F�����ڱ���λ�� ������Fͬ������δ�ɶԵ���������Ԫ��Ϊ (��дԪ�ط���)����Ԫ�ؼ۵����Ų�ͼΪ ��
��3��B��E����Ԫ�ؿ��γ�BE3�ͻ������仯ѧʽΪ ������ԭ���ӻ���ʽΪ �����ӵĿռ乹��Ϊ ��
��4��������BA3���ܽ��ڻ�����A2C�У���ԭ���� ��
��5��������DC�۵����DE2���۵㣬ԭ���� ��
���𰸡���1��N��O��Mg��
��2��ds��Cr��![]() ��
��
��3��NCl3��sp3�������ͣ�
��4��NH3������H2O����֮�������γ������
��5��MgO��MgCl2���������ӻ����O2-���Ӱ뾶С��Cl-���Ӱ뾶��MgO�ľ����ܸ���MgCl2��
�����������������A��B��C��D��E��FΪԭ�������������������Ԫ�أ�A�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ���AΪ��Ԫ�أ�B�Ļ�̬ԭ�Ӻ��������7���˶�״̬��Bԭ�Ӻ��������Ϊ7����BΪ��Ԫ�أ�Dԭ�Ӻ�����4���ܼ��Ҿ��������ӣ���������Ų�ʽΪ1s22s22p63s2����DΪMgԪ�أ�B��C��E����Ԫ��ԭ����δ�ɶԵ�����֮��Ϊ3��2��1����C��E��ԭ����δ�ɶԵ������ֱ�Ϊ2��1��C��ԭ���������ڵ���þԪ��֮�䣬��Cԭ�Ӻ�������Ų�ʽΪ1s22s22p4����CΪ��Ԫ�أ�Fԭ�Ӻ��������ֻ��1�����ӣ����������������ӣ�ԭ����������MgԪ�أ���Fԭ�Ӹ��������Ϊ2��8��18��1����FΪCuԪ�أ�E��ԭ����������Mgԭ�ӣ�D��E���γ�DE2�ͻ������EΪ-1�ۣ���Eԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p5����EΪClԪ�ء�
��1��Mg�Ľ�������ǿ����һ��������С��N��Oͬ���ڣ�Nԭ�ӵ�2p�ܼ�����3�����ӣ�Ϊ�����ȶ�״̬�������ϵͣ��ʵ�Ԫ�صĵ�һ�����ܹ���Ԫ�صĴ�����Ԫ�صĵ�һ�������ɴ�С��˳��ΪN��O��Mg���ʴ�Ϊ��N��O��Mg��
��2��FΪCuԪ�أ���Χ�����Ų�Ϊ3d104s1�������ڱ�λλ��ds������Fͬ������δ�ɶԵ���������Ԫ�أ�����Χ�����Ų�Ϊ3d54s1��Ϊ24��Ԫ�أ���ΪCr����Ԫ�ؼ۵�����ͼΪ![]() ���ʴ�Ϊ��ds��Cr��
���ʴ�Ϊ��ds��Cr��![]() ��
��
��3��B��E����Ԫ�ؿ��γ�BE3�ͻ�����仯ѧʽΪNCl3������Nԭ�Ӽ۲���Ӷ���=3+![]() ��(51��3)=4��Nԭ�Ӻ��й¶Ե��Ӷ���Ϊ
��(51��3)=4��Nԭ�Ӻ��й¶Ե��Ӷ���Ϊ![]() ��(51��3)=1��Nԭ���ӻ���ʽΪsp3�����ӵĿռ乹��Ϊ�����ͣ��ʴ�Ϊ��NCl3��sp3�������ͣ�
��(51��3)=1��Nԭ���ӻ���ʽΪsp3�����ӵĿռ乹��Ϊ�����ͣ��ʴ�Ϊ��NCl3��sp3�������ͣ�
��4������NH3������H2O����֮�������γ������NH3������H2O�У��ʴ�Ϊ��NH3������H2O����֮�������γ������
��5��MgO��MgCl2���������ӻ����O2-���Ӱ뾶С��Cl-���Ӱ뾶��MgO�ľ����ܸ���MgCl2��MgO���۵���ߣ��ʴ�Ϊ��MgO��MgCl2���������ӻ����O2-���Ӱ뾶С��Cl-���Ӱ뾶��MgO�ľ����ܸ���MgCl2��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ���Ҵ���һ�ַdz���Ҫ���������������ɫ��������ζ��Һ�塣ijУ��ѧ��ȤС����Ҵ��Ľṹ�����ʽ���������̽����������벢��ɶ��й�����Ľ��
���۲���˼����
��1���Ҵ����ӵĺ˴Ź��������� �����շ塣
�����̽����
��2����ͬѧ��С�ձ��м�����ˮ�Ҵ����ٷ���һС������ƣ�Լ�̶������۲�ʵ�����������±��н��۲쵽��ʵ�������۲�����ȫ���ж�������Ⱦ�����٣�������������
ʵ������ | �� �� | |
�� | �Ƴ����Ҵ����� | �Ƶ��ܶȴ����Ҵ� |
�� |
��3����ͬѧ���Թ��м���3��4 mL��ˮ�Ҵ�������50�����ҵ���ˮ�У��ٽ�ͭ˿�������ȣ�Ѹ�ٲ����Ҵ��У�������Ρ����ʱ�Ҵ�������Ӧ�Ļ�ѧ����ʽΪ��������ȩ��____________________________________������֤��ʵ����л�������Խ��������ʢ�� ���Թ��в��ھƾ��ƻ�����ֱ�Ӽ��ȣ��۲����ɣ��˷�Ӧ�Ļ�ѧ����ʽΪ__________________________________________��
�����������ۡ�
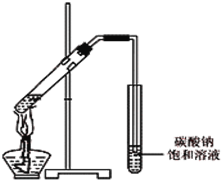
��4����ͬѧ��һ֧�Թ��м���3 mL �Ҵ���Ȼ���ҡ���Թܱ���������2 mLŨ�����2 mL�����ᣬ����ͼ��ʾ���Ӻ�װ�ã���ָ����װ�õ���Ҫ������ �������Ҵ������е���ԭ��Ϊ18Oԭ�ӣ������˷�Ӧ��1 8Oԭ�ӽ������������� �У�����ĸ����
A��ˮ B���������� C��ˮ����������
