题目内容
【题目】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1:45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O,该反应的化学方程式为_____________。
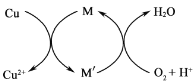
②方法2:先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。M'的化学式为______。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:
①称取样品2.2320g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25. 00mL溶液A,加入足量AgNO3溶液,得AgCl 0. 3444g;
③另取25. 00mL溶液A,调节pH 4 ~ 5,用浓度为0.08000mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液60.00mL。通过计算确定该样品的化学式(写出计算过程)。_____________
【答案】4CuCl + O2+ 8H2O=2Cu2(OH)2Cl2·3H2O Fe2+ Cu2 (OH)3Cl·H2O
【解析】
(1)①方法1: 45 ~ 50℃时,CuCl与水、空气中氧气反应生成Cu2(OH)2Cl2·3H2O;②铜化合价升高,则M化合价降低,应为Fe3+变为Fe2+。
(2)先计算n(Cl-),再计算n(Cu2+),得出n(Cu2+) 、n(Cl-)比例关系,再根据物质化合价代数和为0,再求出摩尔质量,最终得到样品的化学式。
(1)①方法1: 45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,CuCl与水、空气中氧气反应生成Cu2(OH)2Cl2·3H2O,其反应的化学方程式为4CuCl + O2+ 8H2O = 2Cu2(OH)2Cl2·3H2O;故答案为:4CuCl + O2+ 8H2O = 2Cu2(OH)2Cl2·3H2O;
②铜化合价升高,则M化合价降低,应为Fe3+变为Fe2+,M'的化学式为Fe2+;故答案为:Fe2+;
(2)①称取样品2.2320 g,用少量稀HNO3溶解后配成100.00 mL溶液A,消耗氢氧根;②取25. 00 mL溶液A,加入足量AgNO3溶液,得AgCl 0. 3444 g,则n(Cl-)= n(AgCl),其物质的量![]() ;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液60.00 mL,则n(Cu2+)= 0.08000 mol·L-1×0.06L = 0.0048mol,n(Cu2+):n(Cl-) = 0.0048mol:0.0024mol = 2:1,Cu2(OH)bCl·xH2O,即根据化合价代数和为0得出Cu2(OH)3Cl·xH2O,其摩尔质量
;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液60.00 mL,则n(Cu2+)= 0.08000 mol·L-1×0.06L = 0.0048mol,n(Cu2+):n(Cl-) = 0.0048mol:0.0024mol = 2:1,Cu2(OH)bCl·xH2O,即根据化合价代数和为0得出Cu2(OH)3Cl·xH2O,其摩尔质量![]() ,64×2 + 17×3 + 35.5 + 18x = 232.5,解得x = 1,因此该样品的化学式Cu2 (OH)3Cl·H2O,故答案为:Cu2 (OH)3Cl·H2O。
,64×2 + 17×3 + 35.5 + 18x = 232.5,解得x = 1,因此该样品的化学式Cu2 (OH)3Cl·H2O,故答案为:Cu2 (OH)3Cl·H2O。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】甲、乙两同学为探究![]() 与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
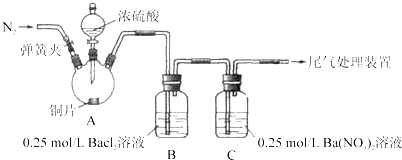
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡,B中有气泡冒出,产生大量白色沉淀,C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(1)A中反应的化学方程式是_________________。
(2)C中白色沉淀是_______,该沉淀的生成表明SO2具有_______性。
(3)C中液面上方生成浅棕色气体的化学方程式是______。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是____;乙在A、B间增加洗气瓶D,D中盛放的试剂是______。
②进行实验,B中现象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:___。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____。