题目内容
下列说法中,正确的是
| A.H35Cl、H37Cl属于同素异形体 |
| B.16O与18O的中子数不同,核外电子排布却相同 |
| C.稳定性:CH4>SiH4;还原性:HCl>H2S |
| D.K+、Ca2+、Mg2+的离子半径依次增大,还原性依次增强 |
B
解析试题分析:A、由同一种元素形成的不同单质互为同素异形体, H35Cl、H37Cl均是化合物,因此不可能属于同素异形体,A不正确;
B、16O与18O互为同位素,质子数相同,核外电子数也相同,因此核外电子排布相同,但中子数不同, B正确;
C、非金属性越强,氢化物的稳定性越强。非金属性是C强于Si,所以稳定性是CH4>SiH4;非金属性越强,相应阴离子的还原性越弱。非金属性是Cl强于S,因此还原性是HCl<H2S,C不正确;
D、金属性越强,相应阳离子的氧化性越弱,所以Mg2+、Ca2+、K+的离子半径依次增大,氧化性依次减弱,D不正确,答案选B。
考点:考查原子核外电子排布以及元素周期律的应用等

下列说法正确的是
| A.金属元素不可能形成含氧酸根离子 |
| B.元素R的含氧酸的化学式是H2RO3,则其气态氢化物的化学式就是RH4 |
| C.金属与非金属元素分界线附近的元素是过渡元素 |
| D.形成化合物种类最多的元素在IVA族 |
下表是元素周期表的一部分,请根据表中a~k对应元素,回答下列有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | a | | b | |
| 3 | c | d | e | f | | g | h | |
| 4 | J | | | | | | k | |
(1)写出a的原子的最外层电子排布式 ,a的原子最外层有 个未成对电子。
(1)在上述元素中的最高价氧化物对应的水化物中,最强酸的化学式是 ;最强碱与两性氢氧化物反应的化学方程式为: 。
(1)写出上述元素中和Ar核外电子排布相同的离子半径由大到小的顺序: (用离子符号表示),上述两种元素能结合成XY型离子化合物,且每个阴、阳离子中均含10个电子,已知常温下该物质的水溶液显碱性,其原因是 (用离子方程式表示)。
(1)下列能用作f和g元素非金属性强弱比较的判断依据的是( )
A.单质熔点:
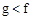
B.最高价氧化物对应水化物的酸性:
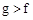
C.最高价氧化物对应水化物的溶解性:
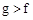
D.f不能与氢气反应,g能与氢气反应
X、Y、Z是原子序数依次增大的同一短周期元素。X为金属元素,X的单质能与冷水发生剧烈反应;Y的最外层电子数是核外电子层数的2倍,X与Y可形成化合物X2Y;Z单质为共用一对电子对的双原子分子。下列说法不正确的是( )
| A.Y2—的还原性较Z—强 |
| B.Y的氢化物与X2Y所含化学键的类型相同 |
| C.YO2与Z2均可作为漂白剂,但起漂白作用的原理不同 |
| D.以石墨为电极电解XZ的水溶液,在阴极附近滴入酚酞可观察到溶液显红色 |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素
的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中常用的金属材料。下列说法正确的是
| A.原子半径的大小顺序:rX> rY> rW> rQ |
| B.元素Q和Z能形成QZ2型的共价化合物 |
| C.工业上常用电解的方法制备X、Y的单质 |
| D.X、Y的最高价氧化物的水化物之间不能反应 |
下列说法中,正确的是
| A.I A族元素的金属性比ⅡA族元素的金属性强 |
| B.ⅥA族元素的氢化物中,最稳定的氢化物常温时为无色液体 |
| C.某主族元素X的气态氢化物化学式为HX,则其最高正价为+7价 |
| D.金属元素的原子只有还原性,金属阳离子只有氧化性 |
短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y,四种元素原子最外层电子数之和为14。下列叙述正确的是
| A.气态氢化物的热稳定性:HnY>HnW |
| B.同周期元素中W的最高价氧化物对应水化物的酸性最强 |
| C.Y和X、Z和X组成的常见化合物中化学键的类型相同 |
| D.原子半径的大小顺序: rW>rZ>rY>rX |
甲、乙、丙、丁为四种主族元素,甲元素与乙、丙、丁三种元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断正确的是
| A.原子半径:丙>乙>甲>丁 |
| B.气态氢化物的稳定性:甲>丙 |
| C.最高价氧化物对应的水化物的酸性:丁>甲 |
| D.乙和甲或乙和丁所能形成的化合物都是剧毒物质 |
X是第三周期非金属元素,该原子如果要达到8电子稳定结构,需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是
| A.X最高价氧化物对应的水化物不一定是强酸 |
| B.X元素的氢化物化学式一定为H2X |
| C.X的单质—定是良好的半导体材料 |
| D.X元素的氧化物—定能与烧碱反应 |