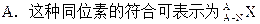题目内容
A、B、C、D、E五种元素,它们的原子序数由A至E逐渐增大。D 的氢化物的分子式为H2D;D的最高价氧化物中D的质量分数为40%,且D原子的原子核中质子数和中子数相等。A原子最外电子层有4个电子。B的阴离子与C的阳离子和氖原子的电子层结构相同。E原子的M电子层上共有7个电子。常温常压下,B单质是气体,已知0.1 mol的B 单质与H2完全反应需2.408×1023个氢原子。C单质在加热条件下与B单质反应生成淡黄色固体。根据上述情况,试完成下列各问题:
(1)A—E的元素符号为___________、___________、___________、___________、___________。
(2)C位于元素周期表中第___________周期、第___________族,其阳离子的结构示意图为___________。
(3)D原子的电子式为___________;E离子的符号为___________。
(4)A元素与其余4种元素形成化合物的化学式为(仅限于由2种元素组成) ___________、___________、___________、___________。
(5)C单质和B单质在加热条件下生成A2B2反应的化学方程式为______________________;
反应中___________为氧化剂,___________为还原剂。
(6)1.15 g的C单质溶于50 mL水中,所得溶液中溶质的质量分数为___________。
(1)A—E的元素符号为___________、___________、___________、___________、___________。
(2)C位于元素周期表中第___________周期、第___________族,其阳离子的结构示意图为___________。
(3)D原子的电子式为___________;E离子的符号为___________。
(4)A元素与其余4种元素形成化合物的化学式为(仅限于由2种元素组成) ___________、___________、___________、___________。
(5)C单质和B单质在加热条件下生成A2B2反应的化学方程式为______________________;
反应中___________为氧化剂,___________为还原剂。
(6)1.15 g的C单质溶于50 mL水中,所得溶液中溶质的质量分数为___________。
(1)C O Na S Cl
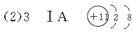
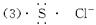
(4)CO CO2 CS2 CCl4
(5)2Na+O2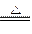 Na2O2 O2 Na
Na2O2 O2 Na
(6)3.91%
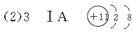
(4)CO CO2 CS2 CCl4
(5)2Na+O2
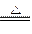 Na2O2 O2 Na
Na2O2 O2 Na(6)3.91%
根据D的氢化物的化学式和D的氧化物中D的含量,D是硫元素,再根据B的阴离子与C的阳离子和氖原子的电子层结构相同,A至E原子序数逐渐增大且E原子的M电子层上共有7个电子,所以Z为Cl元素。常温常压下,B单质是气体,已知0.1 mol的B 单质与H2完全反应需2.408×1023个氢原子,C单质在加热条件下与B单质反应生成淡黄色固体,可知A是碳元素、B是氧元素、C是钠元素、E是氯元素。

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目