题目内容
【题目】(14分)下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
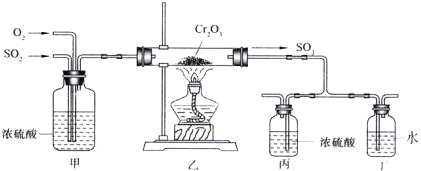
试填写下列空白:
(1)写出工业上用FeS2制取SO2的化学方程式 。
(2)写出上图中部分装置的作用:①甲_________________;
②丙和丁: 。
(3)若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因是:①丙中插入浓硫酸溶液的导管插得太深,使两个吸收瓶内的压强差较大,导致SO3从丁的水中冒了出来,与水形成酸雾;② 。
(4)上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应,甲和乙相当于 ;丙和丁相当于 。
(5)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是 (填下列各项的序号)。
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
【答案】(1)4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)①干燥SO2和O2 ②吸收SO3并做对照实验
(3)②浓硫酸对SO3的吸收效果远好于水的吸收效果,SO3被浓硫酸充分吸收
(4)接触室 吸收塔 (5)D
【解析】
试题分析:(1)黄铁矿的主要成分为FeS2,被氧气氧化为Fe2O3和SO2,反应的方程式为4FeS2+11O2![]() 2Fe2O3+8SO2。
2Fe2O3+8SO2。
(2)甲中浓硫酸的作用是干燥SO2和氧气;用浓H2SO4吸收SO3,无酸雾 ;用水吸收SO3会产生酸雾,因此丙和丁装置的作用是吸收SO3并做对照实验。
(3)根据题意可知另一个原因可能是浓硫酸对SO3的吸收效果远好于水的吸收效果,SO3被浓硫酸充分吸收。
(4)黄铁矿的煅烧在接触室内进行,SO3的吸收在吸收塔内进行,因此甲和乙相当于接触室;丙和丁相当于吸收塔;
(5)A、将硫铁矿粉碎可以增大反应物的接触面积,使燃烧速率更快,反应更充分,A错误;B、净化SO2的主要目的是防止杂质使催化剂中毒,B错误;C、催化剂只能提高反应速率,不能提高SO2的转化率,C错误;D、SO3用98%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全,D正确,答案选D。