题目内容
下列有关说法正确的是
| A.0.1mol/LNa2CO3溶液35℃时的碱性比25℃时强,说明盐类水解反应是放热反应 |
| B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br 、I的非金属性递增的规律 |
C.2SO2(g)+O2(g)  2SO3(g) △H<0,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 2SO3(g) △H<0,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 |
| D.室温下,同浓度的Na2CO3溶液的pH比 Na2SiO3溶液的pH小,说明非金属性C>Si |
D
解析试题分析:A、0.1mol/LNa2CO3溶液35℃时的碱性比25℃时强,说明升高温度促进碳酸钠的水解,升高温度,平衡向吸热反应方向移动,则盐类水解反应是吸热反应,错误;B、元素的非金属性强弱与元素气态氢化物的酸性强弱无关,错误;C、2SO2(g)+O2(g)  2SO3(g) △H<0,其它条件不变时加入催化剂,反应速率v(SO2)增大,但平衡不移动,SO2转化率不变,错误;D、根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大知,室温下,同浓度的Na2CO3溶液的pH比 Na2SiO3溶液的pH小,说明碳酸的酸性大于硅酸,非金属性C>Si,正确。
2SO3(g) △H<0,其它条件不变时加入催化剂,反应速率v(SO2)增大,但平衡不移动,SO2转化率不变,错误;D、根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大知,室温下,同浓度的Na2CO3溶液的pH比 Na2SiO3溶液的pH小,说明碳酸的酸性大于硅酸,非金属性C>Si,正确。
考点:考查外界条件对化学平衡、盐类水解平衡的影响规律

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
下列有关元素的性质及其递变规律正确的是
| A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| B.第二周期元素从左到右,最高正价从+1递增到+7 |
| C.同主族元素的简单阴离子还原性越强,水解程度越大 |
| D.同周期金属元素的化合价越高,其原子失电子能力越强 |
某元素X最高价含氧酸的分子量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是( )
| A.X的最高化合价为+4 |
| B.X是第二周期VA族元素 |
| C.X是第二周VIA族元素 |
| D.X的最高价含氧酸的分子式可表示为H3XO4 |
短周期金属元素甲~丁在元素周期表中的相对位置如表所示: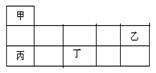
下列判断正确的是( )
| A.原子半径:丙>丁>乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23% =35.453中
| A.75.77%表示35Cl的质量分数 |
| B.24.23%表示35Cl的原子百分含量 |
| C.35.453表示氯元素的相对原子质量 |
| D.36.966表示37Cl的质量数 |
如图所示是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元系符号。已知X
位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒。下列推测不正确的是( )
| A.原子半径X<Y |
| B.最高价氧化物对应的水化物酸性X>Y |
| C.X的氢化物具有强还原性 |
| D.Y与碘同周期,Y的最高价氧化物对应的水化物的酸性比高碘酸(HIO4)强 |
根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
A.最高价氧化物对应水化物的碱性A>C
B.氢化物的沸点H2D>H2E
C.单质与稀盐酸反应的速率A<B
D.C2+与A+的核外电子数相等