题目内容
【题目】表是元素周期表的一部分,回答下列有关问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
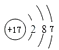
(1)画出原子的结构示意图:④ , ⑧
(2)第三周期(除稀有气体元素)中原子半径最大的元素是(填序号),跟它同周期原子半径最小的元素是(填序号)
(3)元素⑦与元素⑧相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)写出实验室制取元素①的气态氢化物最常用的化学方程式
(5)元素①的最高价氧化物对应的水化物的浓溶液与单质铜反应的化学方程式为 .
【答案】
(1)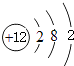 ;
;
(2)③;⑧
(3)Cl;b
(4)Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(5)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
【解析】解:由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、为Ca、为Br.
(1.)④为Mg,原子核外有12个电子,有3个电子层,各层电子数为2、8、2,原子结构示意图为: 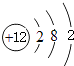 ;⑧为Cl,原子核外有17个电子,有3个电子层,各层电子数为2、8、7,原子结构示意图为:
;⑧为Cl,原子核外有17个电子,有3个电子层,各层电子数为2、8、7,原子结构示意图为:  ,所以答案是:
,所以答案是:  ;
;  ;
;
(2.)同周期自左而右主族元素的原子半径减小,故第三周期(除稀有气体元素)中原子半径最大的元素是 ③,跟它同周期原子半径最小的元素是⑧,
所以答案是:③;⑧;
(3.)S和Cl同周期,自左而右非金属性增强,故Cl元素非金属性较强,可根据氢化物的稳定性判断,单质的状态属于物理性质,不能比较非金属性强弱,单质都能与氢氧化钠反应,也不能用于比较非金属性,所以答案是:Cl;b.
(4.)元素①的气态氢化物为NH3 , 实验室用氯化铵与氢氧化钙在加热条件下制备氨气,反应还生成氯化钙与水,反应方程式为:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O,所以答案是:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,所以答案是:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(5.)元素①的最高价氧化物对应的水化物为硝酸,Cu与浓硝酸反应生成硝酸铜、二氧化氮与水,反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
所以答案是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案