题目内容
【题目】铅蓄电池是典型的可充电电池,它的正负极是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO![]()
![]() 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时,正极的电极反应式是_______________________________。
电解液中H2SO4的浓度将变__________,当外电路通过1 mol电子时,理论上负极板的质量增加__________,电池中消耗的硫酸物质的量为__________。
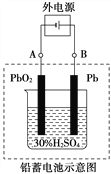
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成______。B电极上生成_______,此时铅蓄电池的正负极与原铅蓄电池的正负极_______。(填“相同”或“相反”)
【答案】 PbO2+4H++SO42-+2e-=PbSO4+2H2O 小 48g 1 mol Pb PbO2 相反
【解析】(1)放电时,铅作负极,二氧化铅作正极,正极上得电子发生还原反应,所以正极的电极反应式是PbO2+2e-+4H++2SO42-=PbSO4+2H2O,正极附近氢离子参加反应导致氢离子浓度减小,溶液的pH增大;根据电池反应式知,原电池放电时,电解液中H2SO4参加反应,所以硫酸浓度将减少;当外电路通过1mol电子时,溶液中消耗1mol硫酸,依据电子守恒计算理论上负极板的质量增加0.5mol×303g/mol-0.5mol×207g/mol=48g;故答案为:PbO2+2e-+4H++2SO42-=PbSO4+2H2O;小;48g;1mol;
(2)在完全放电耗尽PbO2和Pb时,若按如图连接,该装置是电解池,铅板电极为阴极,得电子发生还原反应,二氧化铅作阳极,失电子发生氧化反应,B电极上发生反应为:PbSO4+2H2O-2e-=PbO2+4H++2SO42-,A电极发生反应为:PbSO4=Pb-2e-+SO42-,所以B电极上生成PbO2,A极上生成Pb,此时铅蓄电池的正负极与原铅蓄电池的正负极相反,故答案为:Pb;PbO2;相反。

【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
【实验一】配制并标定醋酸溶液的浓度。取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,然后用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所稀释的醋酸溶液的浓度进行标定。请回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、__________。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液 的体积(mL) | 20.05 | 20.00 | 18.40 | 19.95 |
则①滴定时选用________(A.石蕊 B.酚酞 C.不用指示剂 D.甲基橙)为指示剂(填字母)
②该醋酸溶液的准确浓度为________(保留小数点后四位)。
【实验二】探究浓度对醋酸电离程度的影响。用pH计测定25 ℃时不同浓度的醋酸溶液的pH,结果如下:
醋酸浓度 (mol·L-1) | 0.001 0 | 0.010 00 | 0.020 0 | 0.100 0 | 0.200 0 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是_________________。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度______(填“增大”“减小”或“不变”)。
【实验三】探究温度对醋酸电离程度的影响。
(5)要完成该探究,需要用pH计(或pH试纸)测定 ___________________________。
【醋酸电离的应用】
(6)通过实验测定常温下醋酸的Ka=1×10-5,则0.1 mol·L-1醋酸钠溶液的pH=________。
【题目】【宁夏六盘山高级中学2017届高三第四次模拟考试】由下列事实得出的结论正确的是
事 实 | 结 论 | |
A | HClO与H2SO3反应生成H2SO4和HCl | 非金属性:Cl>S |
B | N2比白磷稳定得多 | 非金属性:N<P |
C | 在约800℃时,金属钠可从熔融的KCl中置换出K | 金属性:Na>K |
D | 工业上电解Na3AlF6和Al2O3的熔融混合物得到Al | 金属活动性:Na>Al |