题目内容
在NaCl和Na2SO4的混合液中,当Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍时,下列叙述正确的是
- A.溶液中可能含有0.5mol Na2SO4和1.5molNaCl
- B.SO42-离子和Cl-离子的物质的量之和等于Na+的物质的量
- C.SO42-所带的电荷数是Na+所带的电荷数的
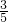 倍
倍 - D.Na2SO4和NaCl物质的量浓度之比为1:3
AD
分析:A、根据0.5mol Na2SO4和1.5molNaCl含有Na+、Cl-的物质的量分别为:2.5mo、1.5mol;
B、根据电荷守恒:2n(SO42-)+n(Cl-)=n(Na+)通过计算得出结论;
C、根据电荷守恒:2Q(SO42-)+Q(Cl-)=Q(Na+),通过计算得出结论;
D、根据电荷守恒:2c(SO42-)+c(Cl-)=c(Na+),通过计算得出结论;
解答:A、0.5mol Na2SO4和1.5molNaCl含有Na+、Cl-的物质的量分别为:2.5mo、1.5mol,Cl-的物质的量是Na+的物质的量的0.6倍,所以Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍,故A正确;
B、由电荷守恒得:2n(SO42-)+n(Cl-)=n(Na+);Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍,即Cl-的物质的量是Na+的物质的量的0.6倍,2n(SO42-)= n(Na+);n(SO42-)=
n(Na+);n(SO42-)= n(Na+),SO42-离子和Cl-离子的物质的量之和为Na+的物质的量的0.8倍,故B错误;
n(Na+),SO42-离子和Cl-离子的物质的量之和为Na+的物质的量的0.8倍,故B错误;
C、由电荷守恒得:所以2Q(SO42-)+Q(Cl-)=Q(Na+),由于Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍,所以Q(Cl-)=0.6Q(Na+),使得:Q(SO42-)=0.2Q(Na+),故C错误;
D、由电荷守恒得:2c(SO42-)+c(Cl-)=c(Na+),由于Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍,所以c(Cl-)=0.6c(Na+),则c(SO42-)=0.2c(Na+),所以Na2SO4和NaCl的物质的量之比为:1:3,故D正确.
故选:AD.
点评:本题考查物质的量浓度的有关计算,难度不大,关键明白溶液呈电中性,阴阳离子所带电荷总数相等.
分析:A、根据0.5mol Na2SO4和1.5molNaCl含有Na+、Cl-的物质的量分别为:2.5mo、1.5mol;
B、根据电荷守恒:2n(SO42-)+n(Cl-)=n(Na+)通过计算得出结论;
C、根据电荷守恒:2Q(SO42-)+Q(Cl-)=Q(Na+),通过计算得出结论;
D、根据电荷守恒:2c(SO42-)+c(Cl-)=c(Na+),通过计算得出结论;
解答:A、0.5mol Na2SO4和1.5molNaCl含有Na+、Cl-的物质的量分别为:2.5mo、1.5mol,Cl-的物质的量是Na+的物质的量的0.6倍,所以Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍,故A正确;
B、由电荷守恒得:2n(SO42-)+n(Cl-)=n(Na+);Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍,即Cl-的物质的量是Na+的物质的量的0.6倍,2n(SO42-)=
 n(Na+);n(SO42-)=
n(Na+);n(SO42-)= n(Na+),SO42-离子和Cl-离子的物质的量之和为Na+的物质的量的0.8倍,故B错误;
n(Na+),SO42-离子和Cl-离子的物质的量之和为Na+的物质的量的0.8倍,故B错误;C、由电荷守恒得:所以2Q(SO42-)+Q(Cl-)=Q(Na+),由于Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍,所以Q(Cl-)=0.6Q(Na+),使得:Q(SO42-)=0.2Q(Na+),故C错误;
D、由电荷守恒得:2c(SO42-)+c(Cl-)=c(Na+),由于Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍,所以c(Cl-)=0.6c(Na+),则c(SO42-)=0.2c(Na+),所以Na2SO4和NaCl的物质的量之比为:1:3,故D正确.
故选:AD.
点评:本题考查物质的量浓度的有关计算,难度不大,关键明白溶液呈电中性,阴阳离子所带电荷总数相等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(2009?龙岩一模)(改编)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其Ksp=[An+]m?[Bm-]n,称为难溶电解质的溶度积.25℃时,向AgCl的白色悬浊液中依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀.已知有关物质的颜色和溶度积如下表:
|
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的离子积.在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀.已知有关物质的颜色和溶度积如下:
|