题目内容
9.将1.8g碳置于2.24L(标准状况)O2中充分燃烧,至全部反应物耗尽,测得放出热量30.65kJ,已知:C(s)+O2(g)=CO2(g)△H=-393.0kJ•mol-1综合上述信息,请写出CO完全燃烧的热化学方程式2CO(g)+O2(g)=2CO2(g)△H=-566 kJ•mol-1.分析 n(C)=$\frac{1.8g}{12g/mol}$=0.15mol,n(O2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,结合反应C+O2=CO2,2C+O2=2CO定量关系分析判断反应生成的产物,n(C):n(O2)=0.15:0.1=3:2,所以生成气体为CO和CO2的混合气体,碳和氧气全部反应,利用直平法写出反应的热化学方程式为:3C(s)+2O2(g)=2CO(g)+CO2(g),1.8g木炭置于2.24L(标准状况)氧气中充分燃烧,至反应物耗尽,测得放出热量30.65kJ,3molC全部反应放热30.65KJ/mol×20=613KJ/mol;
3C(s)+2O2(g)=2CO(g)+CO2(g)△H=-30.65KJ/mol×20=613KJ/mol,
根据C(s)+O2(g)=CO2(g)△H=-393.0kJ.mol-1,结合盖斯定律计算得到CO完全燃烧生成二氧化碳的热化学方程式;
解答 解:n(C)=$\frac{1.8g}{12g/mol}$=0.15mol,n(O2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,结合反应C+O2=CO2,2C+O2=2CO定量关系分析判断反应生成的产物,n(C):n(O2)=0.15:0.1=3:2,所以生成气体为CO和CO2的混合气体,碳和氧气全部反应,1.8g木炭置于2.24L(标准状况)氧气中充分燃烧,至反应物耗尽,测得放出热量30.65kJ,3molC全部反应放热30.65KJ/mol×20=613KJ/mol;
反应的热化学方程式为:
①3C(s)+2O2(g)=2CO(g)+CO2(g)△H=-613KJ/mol
②C(s)+O2(g)=CO2(g)△H=-392.0kJ.mol-1,
结合盖斯定律计算,②×3-①得到CO完全燃烧生成二氧化碳的热化学方程式;
2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol;
故答案为:2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol;
点评 本题考查反应热的计算,盖斯定律的分析应用,难度中等,判断碳与氧气反应产物中一氧化碳与二氧化碳的物质的量是关键,注意反应热△H的单位与符号,容易忽略.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 常见金属单质A可发生如图所示转化(部分反应物,产物和反应条件已略去).F是一种温室气体;气体G的水溶液显碱性;H是一种具有磁性的黑色氧化物;B,C,D,E四种化合物中含有一种相同的元素.
常见金属单质A可发生如图所示转化(部分反应物,产物和反应条件已略去).F是一种温室气体;气体G的水溶液显碱性;H是一种具有磁性的黑色氧化物;B,C,D,E四种化合物中含有一种相同的元素.请回答下列问题:
(1)写出F的电子式
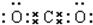 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.(2)写出反应Ⅰ的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,该反应中的氧化剂是H2O.
(3)反应Ⅰ、Ⅱ均有清洁能源H2产生,已知H2的燃烧热为286kJ•mol-1,18g水蒸气变成液态谁放出44kJ的热量.其它相关数据如表:
| 化学键 | O=O(g) | H-H(g) | H-O(g) |
| 键能/kJ•mol-1 | 496 | x | 463 |
| A. | x的值为4 | B. | A的转化率为60% | ||
| C. | B的平衡浓度为0.8 mol/L | D. | D的体积分数为20% |
| A. | 页岩气属于一种新能源 | B. | 页岩气属于一种能源 | ||
| C. | 页岩气属于清洁能源 | D. | 页岩气属于不可再生能源 |
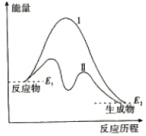 如图表示某反应的能量变化,对于该图的理解,你认为一定正确的是( )
如图表示某反应的能量变化,对于该图的理解,你认为一定正确的是( )| A. | 曲线Ⅰ和曲线Ⅱ分别表示两个化学反应的能量变化 | |
| B. | 曲线Ⅱ可表示反应2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2的能量变化 | |
| C. | 该反应不需要加热就能发生 | |
| D. | 该反应的△H=E2-E1 |
| A. | c(Z)=0.3mol/L | B. | c(X2)=0.3mol/L | C. | c(Y2)=0.2mol/L | D. | c(Z)=0.4mol/L |