题目内容
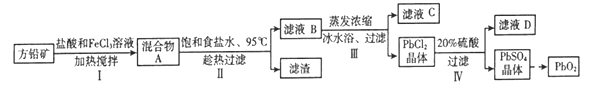
【题目】铅蓄电池有广泛的应用,由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下:
査阅资料:①PbCl2(s)+2Cl-(aq) ![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
②Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9、7.0
③不同温度和浓度的食盐溶液中PbCl2的溶解度(g L-1):
| 20 | 40 | 60 | 100 | 180 | 260 | 300 |
13 | 3 | 1 | 0 | 0 | 3 | 9 | 13 |
50 | 8 | 4 | 3 | 5 | 10 | 21 | 35 |
100 | 17 | 11 | 12 | 15 | 30 | 65 | 95 |
(1)步骤I中FeCl3溶液与PbS反应生成PbCl2和S的化学方程式为__________________;
加入盐酸控制pH小于1.0的原因是________。
(2)步骤II中浸泡溶解时采用95℃和饱和食盐水的目的分别是____________、_____________。
(3)步骤III中将滤液B蒸发浓缩后再用冰水浴的原因是___________(请用平衡移动原理解释)。
(4)骤IV需用溶质质量分数为20%、密度为1.22 g·cm-3的硫酸溶液,现用溶质质量分数为98.3%、密度为1.84 g·cm-3的浓硫酸配制,需用到的玻璃仪器有___________ (填相应的字母)。
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒 F.胶头滴管
(5)用铅蓄电池为电源,采用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水(最终Cr2O72-转化为Cr(OH)3, NO2-转化为无毒物质),其装置如下图所示。
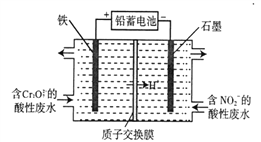
①左池中Cr2O72-转化为Cr3+的离子方程式是__________________。
②当阴极区消耗2 mol NO2-时,右池减少的H+的物质的量为______________ mol。
【答案】 2FeCl3+PbS=PbCl2+S↓+2FeCl2 抑制 Fe3+ 的水解 加快浸泡速率 增大PbCl2在氯化钠溶液中的溶解度 用冰水浴使反应PbCl2(s)+2Cl- (aq) ![]() PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出。 ABEF Cr2O72-+6Fe2+ +14H+=2Cr3++6Fe2+ +7H2O 2
PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出。 ABEF Cr2O72-+6Fe2+ +14H+=2Cr3++6Fe2+ +7H2O 2
【解析】本题考查化学工艺流程,从化学反应原理、元素及其化合物的角度入手,(1)步骤I中FeCl3溶液与PbS反应生成PbCl2和S,即FeCl3+PbS→FeCl2+PbCl2+S,FeCl3作氧化剂,PbS作还原剂,S被氧化,Pb的化合价没发生变化,根据化合价的升降进行配平,即2FeCl3+PbS→PbCl2+S↓+2FeCl2,然后根据原子守恒,配平其他,即反应方程式为:2FeCl3+PbS=PbCl2+S↓+2FeCl2;根据信息②,Fe3+、Pb2+以氢氧化物形式开始沉淀时的pH值分别为1.9、7.0,因此加入盐酸控制pH小于1的原因是抑制Fe3+水解;(2)升高温度,可以加快浸泡速率,根据PbCl2在NaCl中的溶解度,温度越高,PbCl2的溶解度越大,因此95℃增大PbCl2在氯化钠溶液中的溶解度,根据根据信息①Cl-浓度增大,平衡向正反应反应移动,增大PbCl2溶解度;(3)根据PbCl2(s)+2Cl-(aq) ![]() PbCl42-(aq) △H>0,正反应方向是吸热反应,降低温度,平衡向逆反应方向移动,使PbCl42-转化成PbCl2,促使PbCl2晶体析出;(4)配制一定质量分数的溶液,需要的仪器有烧杯、量筒、玻璃棒、胶头滴管,有时也需要用托盘天平;(5)①铁作阳极,根据电解原理,阳极反应式为Fe-2e-=Fe2+,利用Fe2+的还原性,与Cr2O72-发生氧化还原反应,离子反应是Cr2O72-+6Fe2+ +14H+=2Cr3++6Fe2+ +7H2O;②阴极反应式为2NO2-+8H++6e-=N2↑+4H2O,消耗2molNO2-的同时消耗8molH+,左池需要向右池转移6molH+,因此右池减少H+的物质的量为2mol。
PbCl42-(aq) △H>0,正反应方向是吸热反应,降低温度,平衡向逆反应方向移动,使PbCl42-转化成PbCl2,促使PbCl2晶体析出;(4)配制一定质量分数的溶液,需要的仪器有烧杯、量筒、玻璃棒、胶头滴管,有时也需要用托盘天平;(5)①铁作阳极,根据电解原理,阳极反应式为Fe-2e-=Fe2+,利用Fe2+的还原性,与Cr2O72-发生氧化还原反应,离子反应是Cr2O72-+6Fe2+ +14H+=2Cr3++6Fe2+ +7H2O;②阴极反应式为2NO2-+8H++6e-=N2↑+4H2O,消耗2molNO2-的同时消耗8molH+,左池需要向右池转移6molH+,因此右池减少H+的物质的量为2mol。

 阅读快车系列答案
阅读快车系列答案