题目内容
向一定物质的量的Fe3O4和Fe的混合物中加入50 mL 2 mol·L-1 H2SO4溶液,在一定条件下恰好使混合物完全溶解,放出448 mL(标准状况)的气体。在所得溶液中加入KSCN溶液,无红色出现,那么,用足量的CO在高温下与相同质量的此混合物充分反应,能得到铁的质量为多少?
5.6 g
解析:
设Fe3O4和Fe的物质的量分别为x、y。
由题意知:放出H2的物质的量为![]() =0.02 mol
=0.02 mol
Fe3O4+4H2SO4====FeSO4+Fe2(SO4)3+4H2O
X 4x x
Fe + H2SO4====FeSO4+H2↑
0.02 mol 0.02 mol 0.02 mol
所得溶液中加入KSCN溶液,无红色出现,说明无Fe3+,必然发生了下列反应:
Fe+Fe2(SO4)3====3FeSO4
x x
则:
解得:![]()
Fe3O4+4CO![]() 3Fe+4CO2
3Fe+4CO2
1 3
0.02 mol 0.06 mol
所以,得到的铁的质量为(0.04 mol+0.06 mol)×56 g·mol-1=5.6 g。

练习册系列答案
相关题目
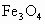 和Fe的混合物中加入
和Fe的混合物中加入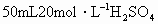 溶液,在一定条件下恰好使混合物完成溶解,放出448mL(标准状况)的气体.在所得溶液中加入KSCN溶液,无红色出现,那么用足量的CO在高温下与相同质量的此混合物充分反应,能得到铁的质量是多少?
溶液,在一定条件下恰好使混合物完成溶解,放出448mL(标准状况)的气体.在所得溶液中加入KSCN溶液,无红色出现,那么用足量的CO在高温下与相同质量的此混合物充分反应,能得到铁的质量是多少?