题目内容
下列叙述中正确的是( )
| A、常温下,0.01mol?L-1醋酸溶液pH=2 | B、95℃纯水的pH<7,说明加热可导致水呈酸性 | C、常温下,将pH=3的醋酸溶液稀释至10倍后溶液pH=4 | D、常温下,将0.2mol?L-1的盐酸与等体积水混合后溶液pH=1 |
分析:A.醋酸为弱酸,不能完全电离;
B.水的电离为吸热过程,加热促进电离,水的离子积常数增大;
C.醋酸为弱酸,加水稀释促进电离;
D.计算稀释后的氢离子浓度,可计算pH.
B.水的电离为吸热过程,加热促进电离,水的离子积常数增大;
C.醋酸为弱酸,加水稀释促进电离;
D.计算稀释后的氢离子浓度,可计算pH.
解答:解:A.醋酸为弱酸,不能完全电离,常温下,0.01mol?L-1醋酸溶液pH>2,故A错误;
B.水的电离为吸热过程,加热促进电离,水的离子积常数增大,但c(H+)=c(OH-),呈中性,故B错误;
C.醋酸为弱酸,加水稀释促进电离,将pH=3的醋酸溶液稀释至10倍后溶液3<pH<4,故C错误;
D.将0.2mol?L-1的盐酸与等体积水混合后,c(H+)=0.1mol/L,则pH=1,故D正确.
故选D.
B.水的电离为吸热过程,加热促进电离,水的离子积常数增大,但c(H+)=c(OH-),呈中性,故B错误;
C.醋酸为弱酸,加水稀释促进电离,将pH=3的醋酸溶液稀释至10倍后溶液3<pH<4,故C错误;
D.将0.2mol?L-1的盐酸与等体积水混合后,c(H+)=0.1mol/L,则pH=1,故D正确.
故选D.
点评:本题考查较为综合,涉及弱电解质的电离以及pH的计算,为高频考点,侧重于学生的分析和计算能力的考查,注意把握弱电解质的电离特点,难度不大.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
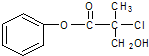 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )| A、有机物A可以在一定条件下与HBr发生反应 | B、1mol A最多能与4mol H2发生加成反应 | C、有机物A与浓硫酸混合加热,可以发生消去反应 | D、1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |


