题目内容
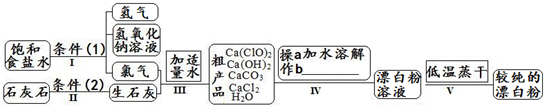
在漂白粉漂白时,不能使漂白粉更好发挥漂白作用的物质是
- A.食盐
- B.CO2和水蒸气
- C.盐酸
- D.食醋(含醋酸)
A
分析:漂白粉漂白时,生成HClO将会使漂白效果更好,若消耗次氯酸根离子且不生成HClO,不能使漂白粉更好发挥漂白作用,以此来解答.
解答:A.食盐对漂白粉的漂白无影响,故A选;
B.CO2和水蒸气、漂白粉反应生成HClO,可更好发挥漂白作用,故B不选;
C.盐酸、漂白粉反应生成HClO,可更好发挥漂白作用,故C不选;
D.食醋、漂白粉反应生成HClO,可更好发挥漂白作用,故D不选;
故选A.
点评:本题考查漂白粉的漂白作用,注意把握强酸制取弱酸的反应原理生成HClO为解答的关键,注重基础知识的考查,题目难度不大.
分析:漂白粉漂白时,生成HClO将会使漂白效果更好,若消耗次氯酸根离子且不生成HClO,不能使漂白粉更好发挥漂白作用,以此来解答.
解答:A.食盐对漂白粉的漂白无影响,故A选;
B.CO2和水蒸气、漂白粉反应生成HClO,可更好发挥漂白作用,故B不选;
C.盐酸、漂白粉反应生成HClO,可更好发挥漂白作用,故C不选;
D.食醋、漂白粉反应生成HClO,可更好发挥漂白作用,故D不选;
故选A.
点评:本题考查漂白粉的漂白作用,注意把握强酸制取弱酸的反应原理生成HClO为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案
相关题目
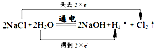
 HCl+HClO
HCl+HClO