题目内容
【题目】硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。下图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:
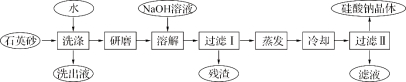
(1)要将洗出液中的溶质析出,采用的方法是 (填“蒸发”、“降温”)结晶;操作时用到的硅酸盐仪器有酒精灯(再填2个仪器) 。
(2)残渣的主要成分为: 。
(3)上述流程中加入NaOH溶液,反应的离子方程式为 。
【答案】(1)蒸发(1分); 蒸发皿(1分)、玻璃棒(1分);
(2)氧化铁(写化学式也可,2分);
(3)SiO2+2OH-=SiO32-+H2O(2分);
【解析】
试题分析:向海边的石英砂(含氯化钠、氧化铁等杂质)中加入水,NaCl溶于水,Fe2O3、SiO2不溶于水,然后过滤,将难溶物研磨,然后加入NaOH溶液,SiO2属于酸性氧化物,能溶解SiO2生成Na2SiO3,Fe2O3不溶于NaOH溶液,过滤得到的残渣为Fe2O3,将滤液蒸发浓缩、冷却结晶,过滤后得到硅酸钠晶体,滤液中含有部分硅酸钠和NaOH,
(1)NaCl能溶于水,从NaCl溶液中得到NaCl晶体,可以采用蒸发结晶的方法;蒸发时使用的仪器有盛放液体的蒸发皿、用于加热的仪器酒精灯、盛放蒸发皿的带铁圈的铁架台;
(2)残渣的主要成分为氧化铁;
(3)NaOH能和SiO2反应生成Na2SiO3和水,离子反应方程式为SiO2+2OH-=SiO32-+H2O。

练习册系列答案
相关题目