题目内容
一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH=4K2CO3+10H2O。有关此电池的推断正确的是( )
| A.负极反应为:14H2O+7O2+28e—=28OH— |
| B.放电一段时间后,负极周围的pH升高 |
| C.理论上消耗1mol C2H6,电路上转移的电子为14mol |
| D.放电过程中,K+向负极移动 |
C
解析试题分析:燃料电池中通入燃料的电极作负极。通入氧气的电极作正极。负极发生反应:2C2H6-28e-+36OH-=4CO32-+24H2O 正极发生反应:7O2+28e-+14H2O=28OH-.反应一段时间后,负极由于消耗了氢氧根离子,使附近的PH减小。每有2mol乙烷发生反应转移电子28mol.如果消耗1mol C2H6,电路上转移的电子为14mol。根据同种电荷相互排斥,异种电荷相互吸引。K+应该向正极移动。
考点:考查燃料电池的电极反应、电子转移及溶液中离子移动的方向等问题的知识。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案电化学在日常生活中用途广泛,图①是镁一次氯酸钠燃料电池,电池总反应为:
Mg+ClO—+H2O= Cl—+ Mg(OH)2↓,图②是Cr2O2—7的工业废水的处理。下列说法正确的是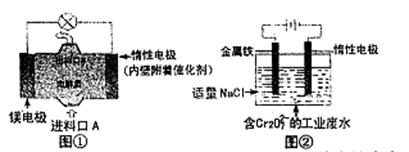
| A.图②中Cr2O2—7离子向惰性电极移动,与该极附近的OH—结合转化成Cr(OH)3除去 |
| B.图②的电解池中,有0.084 g阳极材料参与反应,阴极会有336 mL的气体产生 |
| C.图①中发生的还原反应是:Mg2++ClO—+ H2O+ 2e—=Cl—+ Mg(OH)2↓ |
| D.若图①中3.6 g镁溶解产生的电量用以图②废水处理,理论可产生10.7 g氢氧化铁沉淀 |
500mLKNO3和Cu(NO3) 2的混合溶液中c(NO3-) =6.0mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.原混合溶液中c(K+) 为2 mol·L-1 |
| B.上述电解过程中共转移6mol电子 |
| C.电解得到的Cu的物质的量为0.5 mol |
| D.电解后溶液中c(H+) 为2 mol·L-1 |
在电解水实验时,为了增强导电性,加入的电解质最好选用
| A.Na2SO4 | B.HCl | C.NaCl | D.CuSO4 |
Al-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:
2Al+3 AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是 ( )
| A.当电极上析出0.54 g Ag时,电路中转移的电子为0.01 mol |
B.该隔膜是阳离子交换膜 |
| C.Al电极的反应式为:Al-3e-+3OH-=Al(OH)3 |
| D.正极的电极反应式为:AgO+2e-+2H+=Ag+H2O |
已知某镍镉(Ni-Cd) 可充电电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O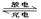 Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
| A.放电时Cd电极发生氧化反应 |
| B.放电时电解质溶液中的OH-向负极移动 |
| C.放电时负极附近溶液的碱性不变 |
| D.充电时阳极反应:Ni(OH)2+OH—+e—=NiOOH+H2O |
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为
| A.a>c>d>b | B.a>b>c>d |
| C.c>a>b>d | D.b>d>c>a |
在用Zn片、Cu片和稀硫酸组成的电池装置中,下列有关说法不正确的是( )
| A.该装置将化学能转变为电能 | B.溶液中的阴离子向锌电极移动 |
| C.Cu极上有气泡产生,发生还原反应 | D.电流方向是从锌片流向铜片 |