题目内容
金属活动顺序表中氰以后金属硝酸盐受热分解成金属单质,二氧化氮和氧气,现有硝酸银34克,受热分解后所得气体通入足量水中所余气体及相应体积判断正确的是(所测气体体积均在标况下测得)( )A.NO2和O2 2L,1L
B.NO和O2,
 1L
1LC.只有O2,1.12L
D.只有NO,约1.5L
【答案】分析:AgNO3加热分解的方程式为2AgNO3 2Ag+2NO2↑+O2↑,通入水中发生4NO2+O2+2H2O=4HNO3,氧气过量,根据方程式计算过量氧气的体积.
2Ag+2NO2↑+O2↑,通入水中发生4NO2+O2+2H2O=4HNO3,氧气过量,根据方程式计算过量氧气的体积.
解答:解:n(AgNO3)= =0.2mol,
=0.2mol,
AgNO3加热分解的方程式为2AgNO3 2Ag+2NO2↑+O2↑,
2Ag+2NO2↑+O2↑,
生成n(NO2)=0.2mol,n(O2)=0.1mol,
通入水中发生4NO2+O2+2H2O=4HNO3,
氧气过量,剩余氧气的物质的量为0.1mol- ×0.2mol=0.05mol,
×0.2mol=0.05mol,
V(O2)=0.05mol×22.4L/mol=1.12L,
故选C.
点评:本题考查硝酸盐的性质以及化学方程式的计算,注意判断所发生的反应,正确书写反应的化学方程式,根据方程式计算,题目难度不大.
 2Ag+2NO2↑+O2↑,通入水中发生4NO2+O2+2H2O=4HNO3,氧气过量,根据方程式计算过量氧气的体积.
2Ag+2NO2↑+O2↑,通入水中发生4NO2+O2+2H2O=4HNO3,氧气过量,根据方程式计算过量氧气的体积.解答:解:n(AgNO3)=
 =0.2mol,
=0.2mol,AgNO3加热分解的方程式为2AgNO3
 2Ag+2NO2↑+O2↑,
2Ag+2NO2↑+O2↑,生成n(NO2)=0.2mol,n(O2)=0.1mol,
通入水中发生4NO2+O2+2H2O=4HNO3,
氧气过量,剩余氧气的物质的量为0.1mol-
 ×0.2mol=0.05mol,
×0.2mol=0.05mol,V(O2)=0.05mol×22.4L/mol=1.12L,
故选C.
点评:本题考查硝酸盐的性质以及化学方程式的计算,注意判断所发生的反应,正确书写反应的化学方程式,根据方程式计算,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
常见金属的冶炼方法
(1)热分解法:适用于冶炼金属活动性较差的金属(金属活动顺序表中 及其以后的金属),如:
(2)电解法:适合冶炼活动性很强的金属(一般在金属活动性顺序表中排在 及其以前的金属).如: ;
; ;
(3)热还原法:用还原剂(C、CO、H2、Al等)还原金属氧化物,适用于金属活动性顺序表中的 与 之间的大多数金属的冶炼.如: ; ; ; ; ;
铝热反应实验现象及化学方程式:
实验说明:
a、Al与Fe2O3能发生铝热反应,与其它较不活泼金属氧化物也能发生铝热反应.
b、铝热反应的最大特点是放出大量的热,在生产上利用这一特点,可用于焊接钢轨,冶金工业上也常用这一原理,使铝与金属氧化物反应,冶炼钒、铬、锰等.如:
Al+ MnO2═ .
(1)热分解法:适用于冶炼金属活动性较差的金属(金属活动顺序表中
(2)电解法:适合冶炼活动性很强的金属(一般在金属活动性顺序表中排在
(3)热还原法:用还原剂(C、CO、H2、Al等)还原金属氧化物,适用于金属活动性顺序表中的
铝热反应实验现象及化学方程式:
| 现 象 | |
| 铝与氧化铁反应的化学方程式 |
a、Al与Fe2O3能发生铝热反应,与其它较不活泼金属氧化物也能发生铝热反应.
b、铝热反应的最大特点是放出大量的热,在生产上利用这一特点,可用于焊接钢轨,冶金工业上也常用这一原理,使铝与金属氧化物反应,冶炼钒、铬、锰等.如:
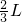 1L
1L