题目内容
下列依据热化学方程式得出的结论正确的是( )
| A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ· mol—1则氢气的燃烧热为△H=-241.8 kJ· mol—1 |
| B.已知C(石墨,s)=C(金刚石,s);△H=+1.9kJ·mol-1,可知石墨比金刚石更稳定 |
| C.已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4 kJ· mol—1可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量等于57.4 kJ |
| D.已知2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2,则△H1>△H2 |
B
解析试题分析:A、氢气的燃烧热指的是1摩尔氢气完全燃烧生成液态水,错误;B、石墨转化为金刚石是吸热反应,说明石墨的能量低,因此石墨稳定,正确;C、醋酸和氢氧化钠发生中和反应,醋酸电离过程要吸热,因此放出热量小于57.4 kJ,错误;D、碳不完全燃烧生成CO放出热量少,因此△H2大,错误。
考点:考查反应热

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案已知:HCN(aq)与NaOH(aq)反应生成1 mol水的ΔH="-12.1" kJ·mol-1;HCl(aq)与NaOH(aq)反应生成1 mol水的ΔH="-57.3" kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+45.2 kJ·mol-1 | D.+69.4 kJ·mol-1 |
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是 ( )
| A.H2(g)的燃烧热为571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C. H2SO4(aq)+ H2SO4(aq)+ Ba(OH)2(aq)= Ba(OH)2(aq)= BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
下列做法不能体现低碳生活的是( )。
| A.减少食物加工过程 |
| B.注意节约用电 |
| C.尽量购买本地的、当季的食物 |
| D.大量使用薪柴为燃料 |
下列说法中正确的是( )。
| A.物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化 |
| B.需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 |
| C.吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多 |
| D.因为3O2===2O3是吸热反应,所以臭氧比氧气的化学性质更活泼 |
北京奥运会开幕式在李宁点燃鸟巢主火炬时达到高潮。奥运火炬采用的是环保型燃料——丙烷,其燃烧时发生反应的化学方程式为C3H8+5O2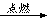 3CO2+4H2O。下列说法中不正确的是( )
3CO2+4H2O。下列说法中不正确的是( )
| A.火炬燃烧时化学能只转化为热能 |
| B.所有的燃烧反应都会释放热量 |
| C.1mol C3H8和5mol O2所具有的总能量大于3mol CO2和4mol H2O所具有的总能量 |
| D.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料 |
已知2 mol氢气完全燃烧生成水蒸气时放出能量484 kJ,且氧气中1 mol O===O键完全断裂时吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收能量为( )。
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
有关键能数据如表所示:
| 化学键 | N≡N | H—H | H—N |
| 键能/kJ·mol-1 | x | 436 | 391 |
A.945.6 B.649 C.431 D.869
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
| A.NH4HCO3和盐酸的反应是放热反应 |
| B.该反应中,热能转化为产物内部的能量 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O ΔH=+Q |