题目内容

A.0. 50 mol·L-1盐酸,0. 50 mol·L-1 NaOH溶液,100 mL量筒1个
B.0.50 mol·L-1盐酸,0. 50 mol·L-1 NaOH溶液,100 mL量筒2个
C.0. 50 mol·L-1盐酸,0. 55 mol·L-1 NaOH溶液,50 mL量筒1个
D.0.50 mol·L-1盐酸,0. 55 mol·L-1 NaOH溶液,50 mL量筒2个
(2)在用温度计测得酸溶液的温度后,若未用水洗净就直接测定碱溶液的温度,则计算出的△H_________(填“偏大”“偏小”或“无影响”)。
(3)怎样才能确保读取的是混合溶液的最高温度?____________
(4)已知H+(aq)+OH-(aq)=H2O(l) △H= - 57. 3kJ·mol-1。若向三份等体积、等物质的量浓度的NaOH 溶液中分别加入稀磷酸、浓硫酸、稀盐酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1 kJ、Q2 kJ、Q3 kJ。则三者大小关系是____________(用Q1、Q2、Q3表示)。
(2)偏大
(3)不断读取温度数据,并记录,直到出现下降,取最大值
(4) Q1<Q3< Q2

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案(1)下列实验操作或对实验事实的描述不正确的有 (填序号)。
A.用托盘天平称量17.55g氯化钠晶体
B.碳酸钠溶液保存在带玻璃塞的试剂瓶
C.用干燥的pH试纸测定新制氯水的pH
D.使用容量瓶配制溶液时,俯视刻度线定容后浓度偏大
E.向饱和FeCl3溶液中滴加少量NaOH溶液,可制取Fe(OH)3胶体
F.除去CO2气体中混有的少量HCl,可以将气体通入饱和碳酸氢钠溶液
(2)下图为中学化学实验中常见的实验装置



A B C
实验室常用装置A制备下表中气体,请将分液漏斗和圆底烧瓶中应装的化学试剂填写完整。
|
气体 |
O2 |
Cl2 |
NH3 |
|
分液漏斗中试剂 |
|
|
浓氨水 |
|
圆底烧瓶中试剂 |
|
KMnO4 |
|
可用B装置排液收集气体,气体应从该装置________(填“左”“右”)管口导进,倘若利用该装置收集Cl2,试剂瓶中盛放的试剂为 。
C装置用于处理多余气体对环境的污染,若利用该装置吸收Cl2,此时烧杯中发生反应的离子方程式为 。倘若该装置中仅仅盛放稀硫酸,通常不适合吸收氨气的原因是 ,若向烧杯中额外再加入一种液态有机物则可安全吸收氨气,这种有机物为 。
(1)下列实验操作或对实验事实的描述正确的有 。
A.用托盘天平称量17.55g氯化钠晶体
B.碳酸钠溶液保存在带橡胶塞的试剂瓶
C.用干燥的pH试纸测定新制氯水的pH
D.使用容量瓶配制溶液时,俯视刻度线定容后浓度偏大
E.向饱和FeCl3溶液中滴加少量NaOH溶液,可制取Fe(OH)3胶体
F.用苯萃取溴水中的溴时,从分液漏斗下口放出将溴的苯溶液
(2)下图为中学化学实验中常见的实验装置
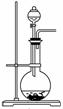
![]()
![]()
A B C
① 实验室常用装置A制备气体,请将分液漏斗和圆底烧瓶中应装的化学试剂的名称填写在下表中。
| 气体 | O2 | Cl2 | NH3 |
| 分液漏斗中试剂 | H2O | 浓氨水 | |
| 圆底烧瓶中试剂 | KMnO4 |
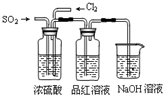
② 可用B装置排液收集气体,气体应从该装置________(填“左”“右”)管口导进,倘若利用该装置收集Cl2,试剂瓶中盛放的试剂为 。
③ C装置用于处理多余气体对环境的污染,若利用该装置吸收Cl2,此时烧杯中发生反应的离子方程式为 。倘若该装置中仅仅盛放稀硫酸,通常不适合吸收氨气的原因是 ,若向烧杯中额外再加入一种液态有机物则可安全吸收氨气,这种有机物为 。


 收集气体(填写装置编号)
收集气体(填写装置编号)