题目内容
将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的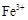 和
和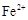 浓度相等。则已反应的
浓度相等。则已反应的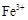 和未反应的
和未反应的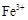 的物质的量之比是
的物质的量之比是
| A.2︰3 | B.3︰2 | C.1︰2 | D.1︰1 |
A
解析试题分析:2Fe3++Fe="=" 3Fe2+.假设反应后产生的Fe2+的物质的量为3摩尔,则反应消耗Fe3+为2摩尔,溶液中为反应的Fe3+物质的量为3摩尔。因此已反应的Fe3+和未反应的Fe3+的物质的量之比是2:3,选项为A.
考点:考查铁元素的单质及化合物之间的反应。

练习册系列答案
相关题目
下列的叙述中不正确的是( )
| A.氯气是一种黄绿色,有刺激性气味的气体 |
| B.将钠保存在水中 |
| C.氯气能溶于水 |
| D.将一小块钠放在石棉网上加热,观察现象 |
甲、乙两烧杯中各盛有100mL3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为( )
| A.5.4g | B.3.6g | C.2.7g | D.1.6g |
已知Cu+2Fe3+=2Fe2++Cu2+。向FeCl3、CuCl2的混合溶液中加入一定量的铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
| A.加入KSCN溶液一定不变红色 | B.溶液中一定含Fe2+ |
| C.剩余固体中一定含Cu | D.溶液中一定含Cu2+ |
向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL.向反应后的溶液中加入c mol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng.再将得到的沉淀灼烧至质量不再改变为止,得到固体pg.则下列关系不正确的是( )
| A.c=1000b/11.2V ? | B.p= m+Vc/125 |
| C.n=m+17Vc | D.5 / 3 m < p < 17 / 9 m |
将1.12 g铁粉加入25 mL 2 mol/L氯化铁溶液中充分反应后,结果是( )
| A.铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 |
| B.往溶液中滴入无色KSCN溶液,溶液无明显现象 |
| C.Fe2+和Fe3+物质的量之比为5∶1 |
| D.氧化产物和还原产物的物质的量之比为1:2 |
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
| A.自然界中没有游离态的钠和铝 |
| B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) |
| C.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 |
| D.m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小 |
下列各组物质相互作用时,生成物不随反应条件或反应物的量变化而变化的是
| A.Na和O2 | B.NaOH和CO2 | C.NaHCO3和NaOH | D.C和O2 |
将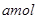 Na2O2和
Na2O2和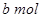 NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3,排出气体为O2、H2O时,
NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3,排出气体为O2、H2O时,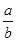 值可能为
值可能为
| A.0.5 | B.0.65 | C.0.85 | D.1.0 |