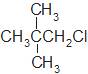题目内容
燃烧某有机物3.0g,生成2.24LCO2(标准状况)和0.1mol水。该有机物的蒸气对空气的相对密度是1.04,求该有机物的分子式。
解:该气体的相对分子质量=1.04×29=30。M(有机物)="30" g/mol。
n(有机物)="m/M=3.0g/30(" g/mol)=0.1mol。n(C)=n(CO2)=2.24L/(22.4L/mol)=0.1mol
.n(H)=2n(H2O)=0.2mol。n(O)="(3.0g-0.1mol×12g/mol-0.2mol×1g/mol)" ÷16g g/mol=0.1mol。所以n(有机物):n(C):n(H):n(O)=0.1:0.1:0.2:0.1=1:1:2:1.故分子式为CH2O。
n(有机物)="m/M=3.0g/30(" g/mol)=0.1mol。n(C)=n(CO2)=2.24L/(22.4L/mol)=0.1mol
.n(H)=2n(H2O)=0.2mol。n(O)="(3.0g-0.1mol×12g/mol-0.2mol×1g/mol)" ÷16g g/mol=0.1mol。所以n(有机物):n(C):n(H):n(O)=0.1:0.1:0.2:0.1=1:1:2:1.故分子式为CH2O。
试题分析:根据阿伏伽德罗定律的推论:在同温同压下,不同气体的密度比等于它们的相对分子质量之比。可推知该气体的相对分子质量=1.04×29=30.所以M(有机物)="30" g/mol。n(有机物)="m/M=3.0g/30(" g/mol)=0.1mol。n(C)=n(CO2)=" 2.24L/(22.4L/mol)=0.1" mol.n(H)=2n(H2O)=0.2mol。则每个分子中含有1个碳原子,2个氢原子。每个分子中含氧原子为:n(O)=(30-12-2)÷16=1.所以该物质的分子式是CH2O。它是甲醛。

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
 ,且M分子中所有原子在一个平面上。M极易与水反应重新变为乙酸,则M分子的结构简式可能是( )
,且M分子中所有原子在一个平面上。M极易与水反应重新变为乙酸,则M分子的结构简式可能是( )