题目内容
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去,其中反应②的条件是“700℃,催化剂”).G是常见的红色金属单质,B、H是空气的主要成分,A、C、E均是常见气体,D是最常见的无色液体. 
请回答下列问题:
(1)E的化学式为 .
(2)A的电子式为 .
(3)写出反应①的离子方程式: .
(4)写出反应②的化学方程式,并标出电子转移的方向与数目: .
【答案】
(1)NO2
(2)![]()
(3)3NO2+H2O=2H++2NO3﹣+NO
(4)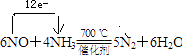
【解析】解:G是常见的红色金属单质,则G为金属Cu;D是最常见的无色液体,则D为H2O;B、H是空气的主要成分,则B、H为N2、O2;F与Cu反应生成不同气体C、E,则F应该为HNO3 , 气体E与水反应生成硝酸,则E为NO2 , C只能为NO气体;A与B反应生成H2O和NO,则A为NH3、B为O2 , 故H为N2 , 反应②的条件是“700℃,催化剂”,为NO与氨气反应生成氮气和水,(1)根据分析可知,E为二氧化氮,化学式为NO2 , 所以答案是:NO2;(2)A为氨气,氨气为共价化合物,氮原子最外层达到8电子稳定结构,氨气的电子式为 ![]() , 所以答案是:
, 所以答案是: ![]() ;(3)反应①为二氧化氮与水的反应,该反应的离子方程式为:3NO2+H2O=2H++2NO3﹣+NO,所以答案是:3NO2+H2O=2H++2NO3﹣+NO;(4)反应②为一氧化氮与氨气反应生成氮气和水,反应的化学方程式为:6NO+4NH3
;(3)反应①为二氧化氮与水的反应,该反应的离子方程式为:3NO2+H2O=2H++2NO3﹣+NO,所以答案是:3NO2+H2O=2H++2NO3﹣+NO;(4)反应②为一氧化氮与氨气反应生成氮气和水,反应的化学方程式为:6NO+4NH3 ![]() 5N2+6H2O,NO中氮元素化合价+2价变化为0价,氨气中氮元素化合价﹣3价变化为0价,电子转移总数为12e﹣ , 标出电子转移的方向与数目为:
5N2+6H2O,NO中氮元素化合价+2价变化为0价,氨气中氮元素化合价﹣3价变化为0价,电子转移总数为12e﹣ , 标出电子转移的方向与数目为: 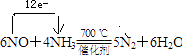 所以答案是:
所以答案是: 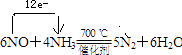 .
.

练习册系列答案
相关题目