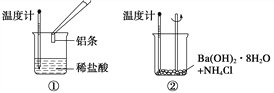
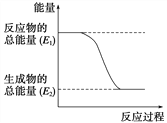
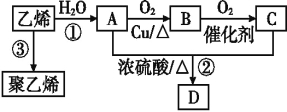
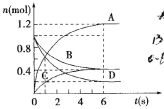
题目内容
【题目】有A 、B 、C 、D四种元素都为短周期元素,原子序数依次增大,A元素原子最外层电子数是其内层电子数的3倍, B 元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,C为原子核内有14个中子的金属,当1.8克C与足量B的最高价氧化物对应水化物反应时,在标准状况下放出气体2.24L ,D的M层上7个电子。
(1)写出各元素名称:A____,B_____,C_____,D_____;
其中D在周期表中的位置:___________________。
(2)B的离子结构示意图:______________ 。
(3)分别写出B和D的最高价氧化物的水化物的化学式______,_______.
(4)比较D的气态氢化物与H2S和HF的稳定性: ___________________(由强到弱排列)。
(5)写出B与C 的最高价氧化物对应水化物之间发生反应的离子方程式:______________ 。
【答案】 氧 钠 铝 氯 第三周期第ⅦA族  NaOH HClO4 HF>HCl>H2S Al(OH)3+ OH- === AlO2-+H2O
NaOH HClO4 HF>HCl>H2S Al(OH)3+ OH- === AlO2-+H2O
【解析】本题考查元素周期表和元素周期律的应用,A元素原子最外层电子数是其内层电子数的3倍,A为O,B 元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,淡黄色固体是Na2O2,即B为Na,C为原子核内有14个中子的金属,当1.8克C与足量B的最高价氧化物对应水化物反应时,在标准状况下放出气体2.24LB的最高价氧化物对应水化物是NaOH,C为金属,能与NaOH反应的金属是Al,即C为Al,D的M层上7个电子,推出D为第三周期VIIA族,即D为Cl,(1)根据上述分析,A为氧、B为钠、C为铝、D为氯;Cl为第三周期VIIA族;(2)B的离子是Na+,其离子结构示意图为: ;(3)B和D最高价氧化物的水化物是NaOH和HClO4;(4)同周期从左向右非金属性增强,同种族从上到下非金属性减弱,因此非金属性F>Cl>S,非金属性越强,其氢化物越稳定,即HF>HCl>H2S;(5)B的最高价氧化物的水化物是NaOH,C的最高价氧化物的水化物是Al(OH)3,氢氧化铝表现两性,即Al(OH)3+OH-=AlO2-+2H2O。
;(3)B和D最高价氧化物的水化物是NaOH和HClO4;(4)同周期从左向右非金属性增强,同种族从上到下非金属性减弱,因此非金属性F>Cl>S,非金属性越强,其氢化物越稳定,即HF>HCl>H2S;(5)B的最高价氧化物的水化物是NaOH,C的最高价氧化物的水化物是Al(OH)3,氢氧化铝表现两性,即Al(OH)3+OH-=AlO2-+2H2O。

 阅读快车系列答案
阅读快车系列答案