题目内容
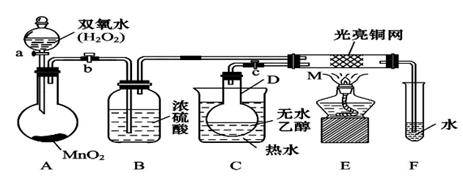
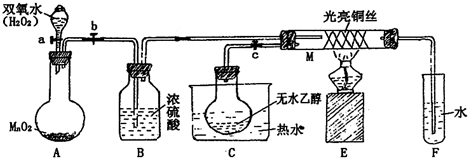
有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图装置(夹持装置仪器已省略),其实验操作为:按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象.试回答以下问题:

(1)A中发生反应的化学方程式:
(2)M处发生的反应的化学方程式为:
(3)从M管中可观察到的现象:
(4)验证乙醇氧化产物的化学反应方程式是:

(1)A中发生反应的化学方程式:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,C中热水的作用:
| ||
使D中乙醇变为蒸气进入M中参加反应
使D中乙醇变为蒸气进入M中参加反应
.(2)M处发生的反应的化学方程式为:
2CH3CH2OH+O2
2CH3CHO+2H2O
| Cu |
| △ |
2CH3CH2OH+O2
2CH3CHO+2H2O
.| Cu |
| △ |
(3)从M管中可观察到的现象:
受热部分的铜丝由于间歇性地鼓入空气而交替出现变黑、变红的现象
受热部分的铜丝由于间歇性地鼓入空气而交替出现变黑、变红的现象
从中可认识到该实验过程中催化剂参加
参加
(填“参加”或“不参加”)了化学反应.(4)验证乙醇氧化产物的化学反应方程式是:
CH3CHO+2[Ag(NH3)2]OH
CH3COONH4+2Ag↓+3NH3+H2O
| ||
CH3CHO+2[Ag(NH3)2]OH
CH3COONH4+2Ag↓+3NH3+H2O
.
| ||
分析:(1)双氧水在二氧化锰作催化剂条件下分解生成水和氧气;温度较高时能加速乙醇的挥发;
(2)在铜作催化剂、加热条件下,乙醇能被氧气氧化生成乙醛和水;
(3)在加热条件下,铜和氧气反应生成黑色的氧化铜,氧化铜和乙醇反应生成红色的铜单质;
(4)乙醛能和银氨溶液发生银镜反应.
(2)在铜作催化剂、加热条件下,乙醇能被氧气氧化生成乙醛和水;
(3)在加热条件下,铜和氧气反应生成黑色的氧化铜,氧化铜和乙醇反应生成红色的铜单质;
(4)乙醛能和银氨溶液发生银镜反应.
解答:解:(1)双氧水在二氧化锰作催化剂条件下分解生成水和氧气,反应方程式为2H2O2
2H2O+O2↑;乙醇具有挥发性,加热能促进乙醇的挥发,使D中乙醇变为蒸气进入M中参加反应,
故答案为:2H2O2
2H2O+O2↑;使D中乙醇变为蒸气进入M中参加反应;
(2)在铜作催化剂、加热条件下,乙醇能被氧气氧化生成乙醛和水,反应方程式为:2CH3CH2OH+O2
2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O;
(3)在加热条件下,铜和氧气反应生成黑色的氧化铜,氧化铜和乙醇反应生成红色的铜单质,所以看到的现象是受热部分的铜丝由于间歇性地鼓入空气而交替出现变黑、变红的现象;在反应前后,实际上铜参加反应,只是在初始反应中作反应物,在最终反应中作生成物,从表面上看没有参加反应,
故答案为:受热部分的铜丝由于间歇性地鼓入空气而交替出现变黑、变红的现象;参加;
(4)乙醛能和银氨溶液发生银镜反应,反应方程式为:CH3CHO+2[Ag(NH3)2]OH
CH3COONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2[Ag(NH3)2]OH
CH3COONH4+2Ag↓+3NH3+H2O.
| ||
故答案为:2H2O2
| ||
(2)在铜作催化剂、加热条件下,乙醇能被氧气氧化生成乙醛和水,反应方程式为:2CH3CH2OH+O2
| Cu |
| △ |
故答案为:2CH3CH2OH+O2
| Cu |
| △ |
(3)在加热条件下,铜和氧气反应生成黑色的氧化铜,氧化铜和乙醇反应生成红色的铜单质,所以看到的现象是受热部分的铜丝由于间歇性地鼓入空气而交替出现变黑、变红的现象;在反应前后,实际上铜参加反应,只是在初始反应中作反应物,在最终反应中作生成物,从表面上看没有参加反应,
故答案为:受热部分的铜丝由于间歇性地鼓入空气而交替出现变黑、变红的现象;参加;
(4)乙醛能和银氨溶液发生银镜反应,反应方程式为:CH3CHO+2[Ag(NH3)2]OH
| ||
故答案为:CH3CHO+2[Ag(NH3)2]OH
| ||
点评:本题考查了乙醇的催化氧化实验,难度不大,注意:催化剂实际上在反应中参加反应,只是在初始反应中作反应物,在最终反应中作生成物,从表面上看没有参加反应.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目

 色:___________________________________________;
色:___________________________________________;