题目内容
下列有关反应热的分析正确的是( )
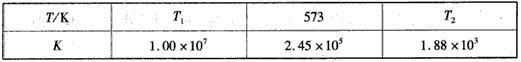
| 已知条件 | 对应反应 | △H | |||
| A | 中和热:57.3KJ/mol | H2SO4(aq)+Ba(OH)2 (aq)═BaSO4(s)+2 H2O(l) |
-114.6KJ/mol | ||
| B | 中和热:57.3KJ/mol | NH3?H2O(aq)+H+(aq) ═NH
|
-57.3KJ/mol | ||
| C | H2燃烧热:285.8KJ/ mol |
H2(g)+
(g) |
大于-285.8KJ/ mol | ||
| D | 碳的燃烧热:395.5 KJ/mol |
2C(s)+O2(g)═ 2CO(g) |
-787KJ/mol |
| A、A | B、B | C、C | D、D |
分析:中和热是强酸强碱的稀溶液完全反应生成1mol水时放出的热量;
燃烧热是1mol纯净的可燃物完全燃烧生成稳定氧化物放出的热量;
依据概念和物质性质进行分析判断;
燃烧热是1mol纯净的可燃物完全燃烧生成稳定氧化物放出的热量;
依据概念和物质性质进行分析判断;
解答:解:A、硫酸和氢氧化钡反应生成硫酸钡沉淀,沉淀过程放热,所以反应热应大于114.6KJ/mol,故A错误;
B、一水合氨是弱电解质存在电离平衡,电离过程是吸热过程,反应的反应热小于57.3KJ/mol,故B错误;
C、燃烧热是1mol纯净的可燃物完全燃烧生成稳定氧化物放出的热量,液态水变化为气态水需要吸热,生成气体水时,反应放出的热量大于-285.8KJ/mol,故C正确;
D、燃烧热是1mol纯净的可燃物完全燃烧生成稳定氧化物放出的热量,反应生成的是一氧化碳不符合燃烧热概念,故D错误;
故选C.
B、一水合氨是弱电解质存在电离平衡,电离过程是吸热过程,反应的反应热小于57.3KJ/mol,故B错误;
C、燃烧热是1mol纯净的可燃物完全燃烧生成稳定氧化物放出的热量,液态水变化为气态水需要吸热,生成气体水时,反应放出的热量大于-285.8KJ/mol,故C正确;
D、燃烧热是1mol纯净的可燃物完全燃烧生成稳定氧化物放出的热量,反应生成的是一氧化碳不符合燃烧热概念,故D错误;
故选C.
点评:本题考查了反应燃烧热、中和热概念的分析应用,注意稳定氧化物的分析,弱电解质电离过程的理解判断,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
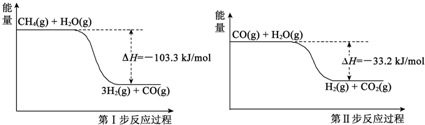 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点. 2NH3(g)
2NH3(g)  CO2(g) +H2(g) △H>0。
CO2(g) +H2(g) △H>0。