题目内容
【题目】氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是___________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________________
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是________________;N2H4分子中氮原子轨道的杂化类型是_________________。
②氨易溶于水的原因是__________________(写出两点即可)
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________ (填标号)。
a.离子键 b.共价键 c.配位键 d.范德华力
(4)HCN的空间构型为_______
(5)尿素的化学式为CO(NH2)2,则碳原子的杂化轨道类型为__________________
【答案】 2s22p3 N>O>C 三角锥形 sp3 氨和水都是极性分子,相似相容;氨与水分子间可形成氢键;氨与水可发生反应(任意两点即可) d 直线 sp2
【解析】(1)基态氮原子的原子序数是7,则其价电子排布式是2s22p3;(2)非金属性越强,第一电离能越大,但氮元素的2p轨道电子处于半充满状态,稳定性强,所以C、N、O三种元素第一电离能从大到小的顺序是N>O>C;(3)①NH3分子中价层电子对数=![]() ,含有一对孤对电子,所以氨气的空间构型是三角锥形;肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物,所以根据氨气的结构可判断N2H4分子中氮原子轨道的杂化类型是sp3;②氨和水都是极性分子,相似相容,氨与水分子间可形成氢键,氨与水可发生反应,所以氨易溶于水;③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,由于硫酸铵中存在离子键、共价键和配位键,则N2H6SO4的晶体内不存在的是范德华力,答案选d;(4)HCN的结构式为H-C≡N,所以空间构型为直线形;(5)尿素的化学式为CO(NH2)2,碳氧之间形成双键,碳氮之间形成单键,则碳原子的杂化轨道类型为sp2。
,含有一对孤对电子,所以氨气的空间构型是三角锥形;肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物,所以根据氨气的结构可判断N2H4分子中氮原子轨道的杂化类型是sp3;②氨和水都是极性分子,相似相容,氨与水分子间可形成氢键,氨与水可发生反应,所以氨易溶于水;③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,由于硫酸铵中存在离子键、共价键和配位键,则N2H6SO4的晶体内不存在的是范德华力,答案选d;(4)HCN的结构式为H-C≡N,所以空间构型为直线形;(5)尿素的化学式为CO(NH2)2,碳氧之间形成双键,碳氮之间形成单键,则碳原子的杂化轨道类型为sp2。

【题目】近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2 L密闭容器内,400 ℃时反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |

(1)上图中表示CH3OH的变化的曲线是___________________。
(2)用H2表示从0~2s内该反应的平均速率v(H2) =__________________。
(3)能说明该反应已达到平衡状态的是_________________。
a.v(CH3OH) =2v(H2) b.容器内压强保持不变
c.2v逆(CO) = v正(H2) d.容器内密度保持不变
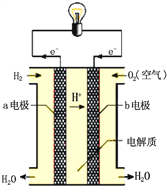
(4)已知常温常压下1g液态甲醇燃烧生成CO2气体和液态水放出22.68kJ的热量,则该反应的热化学方程式为:__________________。CH3OH与O2的反应可将化学能转化为电能,其工作原理如图所示,图中CH3OH从_______________(填A或B)通入,b极的电极反应式是___________________。