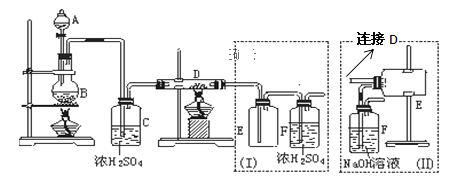
题目内容
【题目】Cl2是一种重要的化工原料,在生产和生活中应用十分广泛。
(1)Cl2可与NaOH溶液反应制取消毒液,请写出消毒液中有效成分的电子式__________。
(2)实验室可用MnO2和浓盐酸反应制取Cl2,反应的化学方程式是____________________。
(3)工业上可采取电解饱和食盐水的方法制取Cl2,阳极的电极反应式为________________。
(4)以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应如下:4HCl(g) + O2(g)![]() 2Cl2(g) + 2H2O(g) H =-115.4 kJmol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
2Cl2(g) + 2H2O(g) H =-115.4 kJmol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
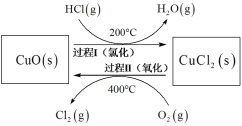
过程I的反应为:2HCl(g) + CuO (s) ![]() CuCl2(s) + H2O(g) H1 =-120.4 kJmol-1
CuCl2(s) + H2O(g) H1 =-120.4 kJmol-1
①过程II反应的热化学方程式为_______。
②过程I流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氯化结束时溶液的现象为_______。
③相同条件下,若将氯化温度升高到300℃,溶液中出现上述现象的时间将缩短,其原因为_______。
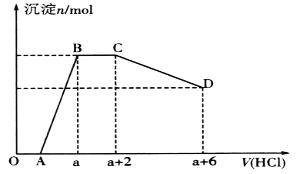
④实验测得在不同压强下,总反应的HCl平衡转化率(ɑHCl)随温度变化的曲线如图:
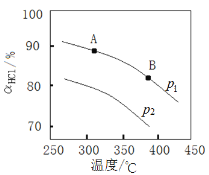
ⅰ.平衡常数比较:K(A)_____K(B) (填“>”“<”或“=”,下同)。
ⅱ.压强比较:p1_____ p2。
(5)以上三种制取Cl2的原理,其共同之处是_______。
【答案】![]() MnO2 + 4HCl(浓)===MnCl2+ Cl2↑+ 2H2O(反应条件为加热) 2Cl- -2e- === Cl2↑ 2CuCl2(s) + O2(g) === 2CuO (s)+ 2Cl2(g) H2= +125.4 kJmol-1 溶液由红色变为无色(或溶液红色变浅) 温度升高,反应速率加快,且氯化程度减少 > > 一定条件下,–1价Cl被氧化生成Cl2
MnO2 + 4HCl(浓)===MnCl2+ Cl2↑+ 2H2O(反应条件为加热) 2Cl- -2e- === Cl2↑ 2CuCl2(s) + O2(g) === 2CuO (s)+ 2Cl2(g) H2= +125.4 kJmol-1 溶液由红色变为无色(或溶液红色变浅) 温度升高,反应速率加快,且氯化程度减少 > > 一定条件下,–1价Cl被氧化生成Cl2
【解析】
(1)次氯酸钠为离子化合物,由阴、阳离子组成;
(2)MnO2和浓盐酸反应生成氯化锰、氯气和水;
(3)阳极上阴离子失去电子发生氧化反应;
(4)由盖斯定律得出热化学方程式;
(5)从化合价的角度分析,都为–1价Cl被氧化生成Cl2。
(1)消毒液中有效成分为次氯酸钠,次氯酸钠为离子化合物,电子式应为![]() ,故答案为:
,故答案为: ![]() 。
。
(2)MnO2和浓盐酸反应生成氯化锰、氯气和水,反应的化学方程式是MnO2 + 4HCl(浓)=MnCl2+ Cl2↑+ 2H2O(反应条件为加热),故答案为:MnO2 + 4HCl(浓)=MnCl2+ Cl2↑+ 2H2O(反应条件为加热)。
(3)电解饱和食盐水制取Cl2,阳极为氯离子放电生成氯气,电极方程式为:2Cl- -2e- = Cl2↑,故答案为:2Cl- -2e- = Cl2↑。
(4)①已知热化学方程式:①4HCl(g) + O2(g)![]() 2Cl2(g) + 2H2O(g) H=-115.4 kJmol-1 ②2HCl(g) + CuO (s)
2Cl2(g) + 2H2O(g) H=-115.4 kJmol-1 ②2HCl(g) + CuO (s) ![]() CuCl2(s) + H2O(g) H1 =-120.4 kJmol-1 ,根据盖斯定律①-②×2可得过程II的热化学方程式为2CuCl2(s) + O2(g) = 2CuO (s)+ 2Cl2(g) H2= +125.4 kJmol-1,故答案为:2CuCl2(s) + O2(g) = 2CuO (s)+ 2Cl2(g) H2= +125.4 kJmol-1。
CuCl2(s) + H2O(g) H1 =-120.4 kJmol-1 ,根据盖斯定律①-②×2可得过程II的热化学方程式为2CuCl2(s) + O2(g) = 2CuO (s)+ 2Cl2(g) H2= +125.4 kJmol-1,故答案为:2CuCl2(s) + O2(g) = 2CuO (s)+ 2Cl2(g) H2= +125.4 kJmol-1。
②由信息可知,氯化初期流出的主要为不含HCl的气体,当氯化结束时,会有过量的氯化氢逸出,氯化氢可中和氢氧化钠溶液,使溶液的红色消失或变浅,故答案为:溶液由红色变为无色(或溶液红色变浅)。
③温度升高,反应速率加快,同时过程I逆向移动,氯化程度减少,所以氯化结束的时间缩短,故答案为:温度升高,反应速率加快,且氯化程度减少。
④ⅰ.由图可知,A点到B点温度升高,氯化氢的平衡转化率减小,平衡逆向移动,平衡常数减小,即K(A) > K(B) ,故答案为:>。
ⅱ.由化学方程式可知,该反应是气体体积减小的反应,增大压强,平衡正向移动,氯化氢的平衡转化率增大,由图可知,温度相同时,p1的氯化氢的平衡转化率大于p2的氯化氢的平衡转化率,故压强p1> p2,故答案为:>。
(5)以上三种制取Cl2的原理,其共同之处是一定条件下,–1价Cl被氧化生成Cl2,故答案为:一定条件下,–1价Cl被氧化生成Cl2。

【题目】25 ℃时,将某一元碱MOH和盐酸溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表,则下列判断不正确的是
实验 序号 | c(盐酸)/ (mol·L-1) | c(MOH)/ (mol·L-1) | 反应后溶 液的pH |
甲 | 0.20 | 0.20 | 5 |
乙 | 0.10 | a | 7 |
A. 由实验甲可判断出MOH为弱碱 B. 将实验甲中所得溶液加水稀释后,c(H+)/c(M+)变小
C. a>0.10 D. MOH的电离平衡常数可以表示为Kb=10-8/(a-0.10)
【题目】T1 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 2.00 | 3.00 |
t1 | 0.80 | |
t2 | 1.80 |
A. 用H2表示反应在t1 min内的平均速率为v(H2)=0.60/t1mol·L-1·min-1
B. 保持其他条件不变,若起始时向容器中充入3.00 mol CO和2.00 mol H2O(g),达到平衡时,n(CO2)=1.20 mol
C. 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO转化率将增大
D. 温度升至T2 ℃,上述反应的平衡常数为0.70,则正反应的ΔH<0
【题目】为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是( )
选项 | A | B | C | D |
被提纯的物质 | 水(煤油) | 氯乙烷(水) | 甲苯(水) | 乙醇(乙酸) |
除杂试剂 | — | NaOH溶液 | — | NaOH溶液 |
分离方法 | 分液 | 蒸馏 | 过滤 | 分液 |
A.AB.BC.CD.D