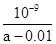题目内容
常温下,实验室有0.01mol?L-1醋酸,下列叙述正确的是
| A.c (CH3COO-) + c (OH-)=" 0.01" mol?L-1 |
| B.与等体积pH = 12的氨水混合后所得溶液显碱性 |
| C.加入少量醋酸钠固体后所得溶液中c (CH3COO-)减小 |
| D.与等体积0.01 mol?L-1NaNO3溶液混合后有:c (NO3-) =" c" (CH3COO-)+c (CH3COOH) |
BD
试题分析:醋酸是弱酸,部分电离出氢离子,则溶液中氢离子浓度远小于醋酸浓度,即c(H+)<0.01mol?L-1,醋酸溶液呈电中性,根据电荷守恒原理可得:c (CH3COO-) + c (OH-)= c(H+)<0.01mol?L-1,故A选项错误;pH=12,则氨水中c (OH-)=Kw/c(H+)=0.01mol?L-1,一水合氨是弱碱,少部分电离出氢氧根离子,则一水合氨浓度远大于0.01mol?L-1,因此等体积混合时氨水过量,醋酸不足,混合后溶液呈碱性,故B选项正确;醋酸钠是易溶于水的强电解质,加入醋酸钠固体,增大醋酸根离子浓度,使醋酸的电离平衡左移,醋酸电离程度减小,虽然醋酸电离出的醋酸根离子减少,但是溶液中醋酸根离子浓度明显增大,故C选项错误;硝酸钠是强电解质,硝酸根离子与硝酸钠的物质的量相等,醋酸是弱酸,存在电离平衡,根据物料守恒原理可知,醋酸和醋酸根离子与硝酸钠的物质的量相等,则溶液中c (NO3-) =" c" (CH3COO-)+c (CH3COOH),故D选项正确。

练习册系列答案
相关题目
 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大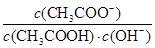 减小
减小