题目内容
(10分) A、B、C、D、E是位于短周期的主族元素。已知:① 热稳定性:H m D > H m C;② C m-、E (m-1)- 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1) HmDm的电子式_____________。
(2) 还原性强弱:C m- ___ E (m-1)- (填“>”或“<”);能证明其还原性强弱的离子方程式为:_____ ___。
(3)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:____________________。
(4) 常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式 。在该溶液中溶质中含有的化学键类型是 。
(5) 在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。

(1) 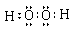 (1分)(2) S2->Cl- (1分) Cl2 + S2-= 2Cl-+ S↓ (2分)
(1分)(2) S2->Cl- (1分) Cl2 + S2-= 2Cl-+ S↓ (2分)
(3) Cl2 + 2OH-= Cl-+ ClO-+ H2O (2分)
(4) H2S+ OH-= HS-+ H2O (2分) 离子键和共价键(1分)
(5) Na、S(1分)
【解析】由①得:C、D同主族,且气态氢化物越稳定,原子的得电子能力越强,而同主族越往下,原子的得电子能力越弱,故D在上(第二周期)、C在下(第三周期);
由②得:C、E在同周期,且C在左,E在右;
由③得:A是同周期最左端元素,B的离子为B3+;
由④得:A、B同在第三周期,则A是钠、B是铝、D是氧、C是硫、E是氯;
第二周期 D
第三周期 C E
(1) H2O2中,氧、氧形成一对共用电子,再氧与每个氢间形成一对共用电子,使氢原子达2电子稳定结构,氧原子达8电子稳定结构;
(2) Cl2 + S2-= 2Cl-+ S↓,在该反应中,S2-做还原剂、Cl-是还原产物,而在氧化还原反应中还原剂、还原产物均有还原性,且还原剂的还原性强于还原产物;
(4)n(H2S)=n(NaOH),即两者按照物质的量1:1反应,故化学方程为:H2S+NaOH=NaHS+H2O,故离子方程式为:H2S+ OH-= HS-+ H2O;溶质为NaHS, Na+、HS-间形成离子键,HS-内氢、硫原子间形成共价键;
(5)若为钠,则Na——Na2O——Na202——NaOH,
涉及的反应依次为:4Na+O2=2Na2O,2Na2O+O2=△=2Na202,2Na202+2H2O=4NaOH+O2↑;
若为硫,则S——SO2——SO3——H2SO4,
涉及的反应依次为:S+O2=点燃=SO2, 2SO2+O2
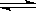 2SO3,
SO3+H2O=H2SO4;
2SO3,
SO3+H2O=H2SO4;

(10分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各离子不重复):
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
(1)用PH试纸测出A、B溶液呈碱性,C、D、E溶液呈酸性
(2)A溶液与E溶液反应既有气体产生又有沉淀产生;A溶液与C溶液反应只有气体产生
(3)D溶液与另外四种溶液反应都能产生沉淀;C溶液只能与D溶液反应产生沉淀则各物质分别是(写化学式):A 、B 、C 、
D 、E 。
(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42— HCO3— NO3— OH— |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生
白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含1molA的溶液与含1molE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 。
(4)C常用作净水剂,用离子方程式表示其净水原理 。
(10分)有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大 ②B与F同主族。
③B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤E元素的电离能数据如下 (kJ·mol-1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
(2)B2A2分子中存在______个σ键,______个π键。
(3)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 | F—D | F—F | B—B | F—B | C—D | D—D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
|
阳离子 |
K+ Na+ Cu2+ Al3+ |
|
阴离子 |
SO42— HCO3— NO3— OH— |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生
白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含1molA的溶液与含1molE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 。
(4)C常用作净水剂,用离子方程式表示其净水原理 。