题目内容
现有标准状况下的35.5g Cl2,回答下列问题:(1)其体积约为 L;
(2)将其与H2完全发生化合反应生成HCl,则生成的HCl的物质的量为 mol;
(3)此反应中电子转移的数目约为 ;
(4)将生成的HCl全部溶于水配成溶液,则完全中和这些HCl需要浓度为10mol/L NaOH的体积为 mL.
【答案】分析:(1)根据标准状况下,Vm=22.4L/mol,利用V=n×Vm=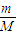 ×Vm来计算;
×Vm来计算;
(2)根据Cl2和H2反应的方程式来计算;
(3)根据化合价的变化来计算转移的电子数;
(4)根据HCl+NaOH=NaCl+H2O来计算;
解答:解:(1)其标况下的体积为V=n×Vm=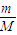 ×Vm=
×Vm=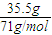 ×22.4L/mol=11.2L,故答案为:11.2;
×22.4L/mol=11.2L,故答案为:11.2;
(2)Cl2与H2完全化合生成HCl,反应方程式:H2 +Cl2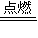 2HCl,
2HCl,
1 2
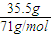 1mol
1mol
生成的HCl的物质的量为1mol,故答案为:1;
(3)H2 +Cl2 2HCl,Cl元素的化合价由0降低为-1价,一个 Cl2得到2个电子,则该反应中转移的电子数为0.5mol×2×NA=NA,故答案为:NA;
2HCl,Cl元素的化合价由0降低为-1价,一个 Cl2得到2个电子,则该反应中转移的电子数为0.5mol×2×NA=NA,故答案为:NA;
(5)由HCl+NaOH=NaCl+H2O,可知,完全中和时NaOH的物质的量为1mol,则NaOH的体积为V=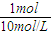 =0.1L=100mL,
=0.1L=100mL,
故答案为:100;
点评:本题注重对基础知识的考查,掌握计算公式是解答本题的关键,难度不大.
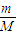 ×Vm来计算;
×Vm来计算;(2)根据Cl2和H2反应的方程式来计算;
(3)根据化合价的变化来计算转移的电子数;
(4)根据HCl+NaOH=NaCl+H2O来计算;
解答:解:(1)其标况下的体积为V=n×Vm=
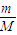 ×Vm=
×Vm=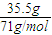 ×22.4L/mol=11.2L,故答案为:11.2;
×22.4L/mol=11.2L,故答案为:11.2; (2)Cl2与H2完全化合生成HCl,反应方程式:H2 +Cl2
 2HCl,
2HCl,1 2
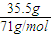 1mol
1mol生成的HCl的物质的量为1mol,故答案为:1;
(3)H2 +Cl2
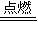 2HCl,Cl元素的化合价由0降低为-1价,一个 Cl2得到2个电子,则该反应中转移的电子数为0.5mol×2×NA=NA,故答案为:NA;
2HCl,Cl元素的化合价由0降低为-1价,一个 Cl2得到2个电子,则该反应中转移的电子数为0.5mol×2×NA=NA,故答案为:NA; (5)由HCl+NaOH=NaCl+H2O,可知,完全中和时NaOH的物质的量为1mol,则NaOH的体积为V=
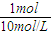 =0.1L=100mL,
=0.1L=100mL,故答案为:100;
点评:本题注重对基础知识的考查,掌握计算公式是解答本题的关键,难度不大.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目