题目内容
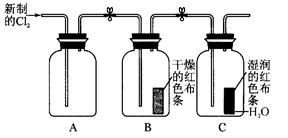
(共14分)某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。请回答:
(1)实验时量取10.00mL氨水样品,配制成100mL待测氨水。
(2)量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_____________________(填“是”“否”“不能确定”)。
(3)①滴定管盛放盐酸前,要先__________________________________________,用少量蒸馏水洗涤后,再__________________________________________________,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_____________________________________。
②向锥形瓶中滴加0.10mol·L-1的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。
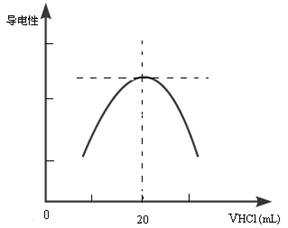
写出氨水与盐酸反应的离子方程式___________________________________________;该氨水样品的物质的量浓度为__________________________。若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果 。(填偏高、偏低、无影响)
(1)否
(2)①检查滴定管是否漏水 ; 用所要盛放的盐酸润洗2~3次;
“0”刻度或“0”刻度以下;
(3) ②NH3·H2O + H+ = NH4+ + H2O ;1.00mol/L ; 偏高
【解析】考查中和滴定实验的原理以及有关误差分析等。
(1)锥形瓶中含有蒸馏水是不会影响实验结果的。
(2)滴定管盛放盐酸前,要首先检查滴定管是否漏水。如果不漏水,用少量蒸馏水洗涤后,再用所要盛放的盐酸润洗2~3次,然后加入盐酸调整液面至凹液面的最低点处于滴定管的“0”刻度或“0”刻度以下。
(3)氨水是弱碱,所以反应的离子方程式是NH3·H2O + H+ =
NH4+ + H2O。当二者恰好反应时,生成强电解质氯化铵,溶液的导电性最强,所以根据图像可知,二者恰好反应时,消耗盐酸是20ml,所以氨水的浓度是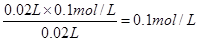 ,则原氨水的浓度是0.1mol/L×10=1.0mol/L。
,则原氨水的浓度是0.1mol/L×10=1.0mol/L。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案(每空1分,共7分)某兴趣小组用石灰石和稀盐酸反应制取CO2,并验证CO2的性质。在确认装置气密行良好后进行实验。把制得的气体通入澄清石灰水中,发现石灰水没有变浑浊。对此展开探究:
(1)[提出问题]澄清石灰水为什么水没有变浑浊?
[猜想与验证]①甲同学认为可能澄清石灰水已变质。他取少量澄清石灰水于试管中,向其中吹气,现象是:__ ___,说明澄清石灰水没有变质。
② 乙同学认为制得的CO2中可能有HCl气体。他作出此猜想的依据是_____________________,他用试管取少量紫色石蕊试液,再通入制得的气体,紫色石蕊试液变红,他得出结论是CO2中混有气体。
③丙同学认为乙同学的实验结论是错误的,理由是_________________________,请你帮助他们设计实验证明:
[实验验证]
|
实验步骤 |
实验现象 |
实验结论 |
|
|
|
CO2中混有HCl气体 |
(2)反思与评价丁同学认为既然用稀盐酸制得的CO2不纯,为何不用H2SO4代替盐酸。请问丁同学的想法对吗?________;理由是_________________________________________。