题目内容
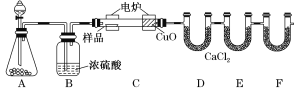
【题目】化学上常用燃烧法确定有机物的组成。下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
回答下列问题:
(1)A装置中盛放黑色固体分液漏斗盛放的物质是__________(名称)
(2)C装置(燃烧管)中CuO的作用是将有机物中的某元素充分氧化生成___________(化学式)
(3)写出E装置中所盛放试剂的名称__________,它的作用是吸收___________(化学式)。
(4)若将B装置去掉会使 __________(元素名称)元素的含量偏__________(大、小)
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为____________。
(6)要确定该有机物的化学式,还需要测定______________。
【答案】双氧水CO2碱石灰CO2氢大CH2O测出有机物的相对分子质量
【解析】
(1)根据实验原理可知装置A是制备氧气的,根据装置的特点可知A装置中分液漏斗盛放的物质是双氧水或水,应该反应的化学方程式是2H2O2![]() 2H2O+O2↑或2Na2O2+2H2O===4NaOH+O2↑;
2H2O+O2↑或2Na2O2+2H2O===4NaOH+O2↑;
(2)由于有机物在燃烧过程中,可能燃烧不充分,即有可能产生CO,而CO能与氧化铜反应生成铜和CO2,所以C装置(燃烧管)中CuO的作用是使有机物充分氧化生成CO2和H2O;
(3)由于有机物燃烧产生CO2,所以E装置的主要作用是吸收生成的CO2,因此其中所盛放试剂是碱石灰或氢氧化钠;
(4)B装置中盛有浓硫酸,其主要的作用是干燥氧气,除去水蒸气,因此如果将B装置去掉会造成测得有机物中含氢量增大,从而产生错误的结论;
(5)D管中无水氯化钙用来吸收水蒸气,质量增加0.72 g,则生成的水是0.72 g,m(H)=![]() ×2×1 g·mol-1=0.08 g;E管质量增加1.76 g,即CO2是1.76 g,m(C)=
×2×1 g·mol-1=0.08 g;E管质量增加1.76 g,即CO2是1.76 g,m(C)=![]() ×12 g·mol-1=0.48 g,所以根据质量守恒定律可知原有机物中氧元素的质量是1.20 g-0.08 g-0.48 g=0.64 g,所以原有机物中C、H、O的原子个数之比是
×12 g·mol-1=0.48 g,所以根据质量守恒定律可知原有机物中氧元素的质量是1.20 g-0.08 g-0.48 g=0.64 g,所以原有机物中C、H、O的原子个数之比是![]() ∶
∶![]() ∶
∶![]() =0.04∶0.08∶0.04=1∶2∶1,因此最简式是CH2O;
=0.04∶0.08∶0.04=1∶2∶1,因此最简式是CH2O;
(6)根据最简式要确定分子式,则还需要知道该物质的相对分子质量,所以要确定该有机物的化学式,还需要测出有机物的相对分子质量。