题目内容
 A、B、C为短周期元素,它们的位置关系如图所示.
A、B、C为短周期元素,它们的位置关系如图所示.(1)若B、C两元素原子序数之和是A元素的原子序数的4倍,则A元素的氢化物中,两种元素原子个数比为1:1的分子的电子式为
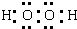
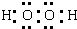
极性共价键
极性共价键
.(2)电解由钠元素和C元素组成的化合物溶液时,可以得到氢气、烧碱和另一种单质,若用此法得到80g烧碱,电子转移的物质的量为
2
2
mol.分析:(1)由图可知应为第二、第三周期元素,令A的原子序数为x,用x表示出B、C的原子序数,根据B、C元素的原子序数之和是A元素原子序数的4倍列方程求x,判断A、B、C元素;
(2)电解氯化钠生成氢气、氯气、NaOH,由电解反应可知,生成2molNaOH转移2mol电子,利用NaOH~e-计算.
(2)电解氯化钠生成氢气、氯气、NaOH,由电解反应可知,生成2molNaOH转移2mol电子,利用NaOH~e-计算.
解答:解:(1)由图可知应为第二、第三周期元素,
令A的原子序数为x,则B的原子序数为x+8-1,C的原子序数为x+8+1.
B、C两元素原子序数之和是A元素的原子序数的4倍,
所以(x+8-1)+(x+8+1)=4x,解得x=8,
所以A为O元素,B为P元素,C为Cl元素.
A元素的氢化物中,两种元素原子个数比为1:1的分子为过氧化氢,其电子式为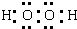 ,C的氢化物为HCl,只含极性共价键,
,C的氢化物为HCl,只含极性共价键,
故答案为: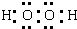 ;极性共价键;
;极性共价键;
(2)电解氯化钠生成氢气、氯气、NaOH,由电解反应可知,生成2molNaOH转移2mol电子,由NaOH~e-可知,转移电子的物质的量等于NaOH的物质的量,为
=2mol,故答案为:2.
令A的原子序数为x,则B的原子序数为x+8-1,C的原子序数为x+8+1.
B、C两元素原子序数之和是A元素的原子序数的4倍,
所以(x+8-1)+(x+8+1)=4x,解得x=8,
所以A为O元素,B为P元素,C为Cl元素.
A元素的氢化物中,两种元素原子个数比为1:1的分子为过氧化氢,其电子式为
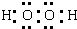 ,C的氢化物为HCl,只含极性共价键,
,C的氢化物为HCl,只含极性共价键,故答案为:
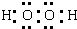 ;极性共价键;
;极性共价键;(2)电解氯化钠生成氢气、氯气、NaOH,由电解反应可知,生成2molNaOH转移2mol电子,由NaOH~e-可知,转移电子的物质的量等于NaOH的物质的量,为
| 80g |
| 40g/mol |
点评:本题考查位置、结构、性质,注意利用短周期的位置及原子序数关系推断元素是解答的关键,熟悉元素周期表的结构、化学键、电解等即可解答,题目难度中等.

练习册系列答案
相关题目
|
A、B、C为短周期元素,它们在周期表中的位置如下图所示.已知B、C两元素所在周期表中族数之和是A元素族数的2倍,B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别为
| |
A. |
Be Na Al |
B. |
B Mg Si |
C. |
C Al P |
D. |
O P Cl |
A、B、C为短周期元素,它们在周期表中的位置如下图所示。已知B、C两元素所在周期表中族数之和是A元素族数的2倍,B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别为
|
|
A |
|
|
B |
|
C |
A.Be Na Al B.B Mg Si C.C Al P D.O P Cl
A、B、C为短周期元素,它们在周期表中的位置如下图所示。已知B、C两元素所在周期表中族数之和是A元素族数的2倍,B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别为
| A | ||
| B | C |
- A.Be Na Al
- B.B Mg Si
- C.C Al P
- D.O P Cl

