题目内容
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
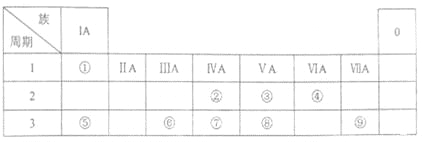
(1)⑨的原子结构示意图为 。
(2)②的气态氢化物分子的结构式为 ⑧的最高价氧化物的水化物的分子式 。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 。(填化学式)
(4)⑤、⑥元素的金属性强弱依次 。(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥形成的简单离子半径依次 。(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式 。
(7)⑤、⑥、⑨的最高价氧化物对应水化物两两均能反应,写出其反应的离子方程式。 、 、 。
【答案】(1) (1分)
(1分)
(2)![]() (1分) H3PO4(1分)
(1分) H3PO4(1分)
(3)HNO3>H2CO3(1分);(4)减小(1分);(5)减小(1分);(6)![]() (1分);
(1分);
(7)Al(OH)3+OH-=AlO2-+2H2O H++OH-=H2O Al(OH)3+3H+=Al3++3H2O(各2分)。
【解析】试题分析:(1)根据元素在周期表的位置可知⑨元素是Cl,其原子结构示意图为 ;(2)②是C,碳元素的气态氢化物分子CH4的结构式为
;(2)②是C,碳元素的气态氢化物分子CH4的结构式为![]() ;⑧是P元素,P的最高价氧化物的水化物的分子式H3PO4;(3)②、③分别是C、N,元素的非金属性N>C,所以元素的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3;(4)⑤、⑥元素分别是Na、Al,同一周期的元素,原子序数越大,元素的金属性就越弱,所以二者的金属性强弱依次减小;(5)④、⑤、⑥形成的简单离子分别是O2-、Na+、Al3+,它们的电子层结构相同,核电荷数越大,离子半径就越小,所以离子半径依次减小;(6)①、④、⑤元素分别是H、O、Na,它们可形成既含离子键又含共价键的化合物是NaOH,该物质的电子式是
;⑧是P元素,P的最高价氧化物的水化物的分子式H3PO4;(3)②、③分别是C、N,元素的非金属性N>C,所以元素的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3;(4)⑤、⑥元素分别是Na、Al,同一周期的元素,原子序数越大,元素的金属性就越弱,所以二者的金属性强弱依次减小;(5)④、⑤、⑥形成的简单离子分别是O2-、Na+、Al3+,它们的电子层结构相同,核电荷数越大,离子半径就越小,所以离子半径依次减小;(6)①、④、⑤元素分别是H、O、Na,它们可形成既含离子键又含共价键的化合物是NaOH,该物质的电子式是![]() ;(7)⑤、⑥、⑨分别是Na、Al、Cl,三种元素的最高价氧化物对应水化物化学式是NaOH、Al(OH)3、HClO4,Al(OH)3是两性氢氧化物,可以与强酸HClO4反应,也可以与强碱NaOH发生反应,NaOH、HClO4也可发生中和反应,其反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O; Al(OH)3+3H+=Al3++3H2O ;H++OH-=H2O。
;(7)⑤、⑥、⑨分别是Na、Al、Cl,三种元素的最高价氧化物对应水化物化学式是NaOH、Al(OH)3、HClO4,Al(OH)3是两性氢氧化物,可以与强酸HClO4反应,也可以与强碱NaOH发生反应,NaOH、HClO4也可发生中和反应,其反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O; Al(OH)3+3H+=Al3++3H2O ;H++OH-=H2O。

 中考解读考点精练系列答案
中考解读考点精练系列答案





